
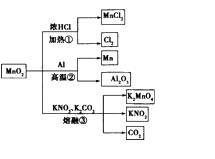
MnO2的一些性质或用途如图,下列说法正确的是 ( )
A.①、②、③三个反应中Mn02均作氧化剂
B.足量Mn02与2 L 10 mol/l、 HCl共热,可生成5 mol C12
C.反应②若生成1 mol Al203,则反应过程中转移12 mol电子·
D.反应③中K2CO3和KNO3的化学计量数均为1
【知识点】氧化还原反应
【答案解析】D 解析:A、①、②反应中MnO2均作氧化剂,③中Mn元素的化合价升高,则作还原剂,故A错误;B、足量Mn02与2L 10 mol/L HCl共热,若完全反应可生成5mol Cl2,但随反应进行,浓盐酸变为稀盐酸,不再反应,则生成氯气小5mol,故B错误;C、反应②若生成1mol Al2O3,则由Al元素的化合价变化可知反应过程中转移1mol×2×(3-0)=6mol电子,故C错误;D、③中发生K2CO3+KNO3+Mn02=K2MnO4+KNO2+CO2↑,K2CO3和KNO3的化学计量数均为1,故D正确;
故答案选D
【思路点拨】本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从化合价角度分析,题目难度不大。


科目:高中化学 来源: 题型:
下列说法正确的是
A.除稀有气体外的非金属元素都能生成不同价态的含氧酸
B.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数一定为m+11
C.在BrCH=CHBr分子中,C—Br键采用的成键轨道是sp—p
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,可能是含有共价键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
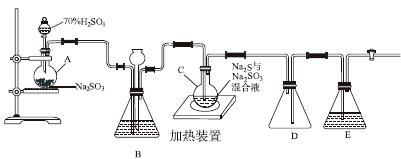
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)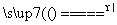 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O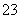 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
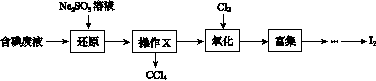
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________________;该操作将I2还原为I-的目的是______________________。
(2)操作X的名称为________。
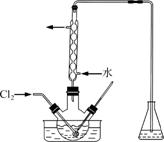
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是______________;锥形瓶里盛放的溶液为________。
(4)已知:5SO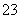 +2IO
+2IO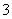 +2H+===I2+5SO
+2H+===I2+5SO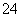 +H2O
+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO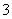 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO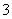 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;________________________________________________________________________
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
你认为下列数据可信的是 ( )
A. 某雨水的pH为5.6
B.某澄清石灰水的浓度是2.0 mol/l
C.某胶体粒子的直径是160 nm
D.某常见气体的密度为1.8 g·/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
在T℃时,将ag NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为bmol。下列叙述中正确的是 ( )
A.溶质的质量分数为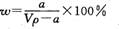
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于O.5w
C.溶液中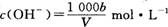
D.溶质的物质的量浓度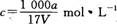
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的Cu0粉末
B.二氧化碳通过Na202粉末
C.铝与Fe203发生铝热反应
D.将锌粒投入Cu(N03)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题

(1)碘是_________(填颜色)固体物质,实验室常用_________方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为______________________;阴极上观察到的实验现象是____________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有
I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
①实验方法 。
②实验现象及结论: 。
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下
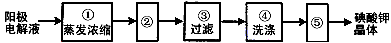
步骤②的操作名称是________________,步骤⑤的操作名称是___________。步骤④洗涤晶体的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由CO2、H2组成的混合气在同温、同压下与氮气的密度相同。则该混合气体中CO2、H2气体的体积比为( )。
A.29∶8 B.22∶1 C.13∶8 D.8∶13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com