
【题目】下列叙述不正确的是( )
A.过氧化钠可作为潜水艇的供氧剂
B.氢气在氯气中安静的燃烧,发出苍白色的火焰
C.Cl2能使湿润的有色布条褪色,则Cl2具有漂白性
D.用BaCl2溶液可鉴别Na2CO3和NaHCO3两溶液
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.淀粉可以制得葡萄糖和酒精
B.铝合金的熔点和硬度均高于纯铝
C.玻璃、塑料、金属、纸类均是可回收的物品
D.硬化油不易被空气氧化而便于储存和运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,请参照①~⑨在表中的位置,回答下列问题:

(1)②的元素符号是__________,⑥在周期表中的位置是___________。
(2)⑦、⑧两元素比较,非金属性强的是(填元素符号)_______,从原子结构角度解释原因_________。
(3)④-⑥这三种元素中,写出最高价氧化物对应水化物两两之间能反应的离子方程式____________________。
(4)写出工业冶炼元素⑤单质的化学方程式_________,不选择热还原法冶炼这种活泼金属的原因是___________________。
(5)元素①和③可以组成很多种物质,写出其中原子个数比为1:4的物质的电子式______,请从化学键角度解释该物质中原子个数比为1:4的原因________________。
(6)已知Se在周期表中的位置如图所示,请画出Se的原子结构示意图________。
请任意写出三种Se物质的化学式,预测其性质(一条即可),并说明预测依据,完成在下列表格中。________
含Se物质化学式 | 性质 | 预测依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氢氧燃料电池装置示意图。

(1)该装置是利用反应 2H2+O2===2H2O 设计而成的,该反应能设计成电池的原因是___________________。
(2)该电池的正极反应物是_______________,判断依据是__________________。
(3)下列关于装置描述不正确的是:__________。
a.导线是电子导体
b.该装置需要点燃才能产生电流
c.Pt电极主要作用是提供得失电子的场所
d.电子从通氧气一级沿导线转移到通氢气一级
(4)该装置是如何形成电流的?请进行完整说明:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:

资料:溴单质容易挥发。
(1)写出“氧化”时的离子方程式_______。
(2)写出第1步“吸收”时的离子方程式________________,该反应体现了SO2的____性。
(3)得到的“含Br2溶液”通过以下不同操作,都可得到溴单质:
① 直接蒸馏得到溴单质,该操作利用的是溴的何种性质:___________;
② 加入四氯化碳萃取,将得到的溴的四氯化碳溶液蒸馏得到溴单质。可以用四氯化碳对溴溶液进行萃取利用的是溴的何种性质:_______________。
(4)对虚线框中的流程进行整体分析,完整说明该流程中所有操作的目的是___________。
(5)工业可用Na2CO3溶液代替二氧化硫的水溶液吸收Br2,完成下列化学反应方程式:
___Br2+___Na2CO3=___NaBrO3+____CO2+__ ______
若有480g溴完全反应,转移电子的物质的量为__________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的说法错误的是( )
A.热稳定性:HCl>H2S
B.原子半径:N>O
C.结合质子能力:S2﹣>Cl﹣
D.酸性:H2SO3>H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2mol NO2,发生下列反应2NO2(g) ![]() N2O4(g) ΔH < 0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图。下列对t1时刻改变条件的推测中正确的是
N2O4(g) ΔH < 0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图。下列对t1时刻改变条件的推测中正确的是
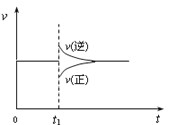
A.保持压强不变,升高反应温度
B.保持温度和容器体积不变,充入1mol N2(g)
C.保持温度和容器体积不变,充入1mol N2O4 (g)
D.保持温度和压强不变,充入1mol N2O4 (g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)常温时,AlCl3的水溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):________________________。AlCl3溶液蒸干并灼烧得到的物质是__________(填化学式)。
(2)泡沫灭火器灭火时发生反应的离子方程是____________;
(3)为了使Na2S溶液中![]() 的比值变小,可加入的物质是_______
的比值变小,可加入的物质是_______
A.适量盐酸 B.适量NaOH溶液
C.适量KOH溶液 D.适量蒸馏水
(4)已知25℃ 时,Ksp[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02molL-1,如要生成Cu(OH)2 沉淀,应调整溶液的pH,使之大于______________。
(5)已知c(Ca2+)≤10-5 mol·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9。在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(CO![]() )=10-3 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。
)=10-3 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是( )
A. 乙醇与浓H2SO4共热170℃
B. 乙烯使溴水褪色
C. 甲苯与浓硫酸、浓硝酸混合
D. 苯与Cl2一定条件生成六氯环己烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com