
【题目】无机化合物可根据其组成和性质进行分类。以下是一组对“一些物质与水反应”的分类图,请按要求填空:

(1)上述分类中,分成A、B两组的依据是___________________________;
(2)C组物质与水反应的离子方程式为_______________________________
(3)D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶1的物质有____(填化学式)。
(4)E组中________(填化学式)是大气主要污染物之一,易形成酸雨。
(5)实验室由Al3+制备Al(OH)3时,应选择F组中________(填化学式)的水溶液,离子方程式为________________________________。
【答案】 与水是否发生氧化还原反应 2Na+2H2O=2Na++2OH-+H2↑ Na2O2、Cl2 SO2 NH3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】由分类的结果看,A组物质与水反应后,化合价都不发生变化,而B组化合价都有变化。C组物质是水只做氧化剂的,只有钠。D组物质是水既不做氧化剂又不是还原剂的,氯气、过氧化钠、二氧化氮都符合,反应的化学方程式分别为Cl2+H2O=HCl+HClO、2Na2O2+2H2O=4NaOH+O2↑、3NO2+H2O=2HNO3+NO。
(1)上述分类中,分成A、B两组的依据是与水是否发生氧化还原反应(或化合价是否发生变化);
(2)C组物质与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑
(3)D组物质与水反应中,Na2O2和Cl2化合价发生变化的都是同一种元素,且一半被氧化另一半被还原,所以氧化剂和还原剂物质的量之比为1∶1的物质有Na2O2、Cl2。
(4)E组中SO2是大气主要污染物之一,易形成酸雨。
(5)实验室由Al3+制备Al(OH)3时,应选择F组中NH3的水溶液,离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 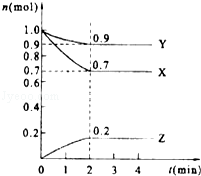
(1)当反应进行到第min,该反应达到平衡.
(2)反应从开始至2分钟末,用X的浓度变化表示的平均反应速率为v(X)=
(3)Y的转化率是
(4)由图中所给数据进行分析,该反应的化学方程为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( ) 
A.B 的M层电子数是K层的3倍
B.C 的离子具有与 Na+相同的电子层结构
C.A 与 D 形成的化合物属于离子化合物
D.C 的简单阴离子比 D 的简单阴离子还原性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山西是我国重要的能源、化工基地,也是卫星发射基地.请回答下列问题.
(1)目前我省居民使用的主要能源有①煤②石油③风能④天然气⑤电能等,其中属于可再生能源的是(填序号),请再举出我省居民生活中的一种可再生能源 .
(2)天然气不仅可以用来直接燃烧提供能量,还是重要的化工原料.天然气的主要成分是 , 它可以与水在高温条件下反应制得水煤气(CO和H2),反应的化学方程式是 , 此时得到的水煤气中 CO和 H2的质量比是 .
(3)火箭可将卫星送入太空.火箭推进器中的强还原剂液态肼(N2H4)和强氧化剂混合时,发生反应 N2H4+2X═N2+4H2O,瞬间产生大量气体,推动火箭前进.由此判断X的化学式是 , 该反应为放热反应,反应物的总能量生成物总能量(填“高于”、“低于”或“等于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图. 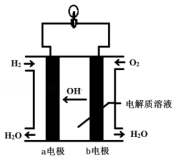
请回答下列问题.
(1)电池是将化学能直接转化为能的装置.
(2)氢氧燃料电池中发生反应的化学方程式是 . 作为碱性氢氧燃料电池,该电池的电解质溶液可以是 .
(3)b 电极上的反应为,则该电极为电池的极.从氧化还原角度分析,该反应属于反应.
(4)氢氧燃料电池与普通电池相比,其优点是(答出一点即可).但作为手机电池,长时间使用时,会感觉手机发烫,这是因为有一部分能量转化为能,所以它还需要解决一些问题,如:手机壳必须多开一个排气孔,可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 常温下,将NaOH溶液滴入醋酸溶液中直至过量,水的电离程度增大
B. 将CH3COOH溶液从20℃升温至30℃,溶液中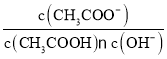 增大
增大
C. HCl是强电解质,所有盐酸中不存在电离平衡
D. 向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液中 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸的电离方程式为![]()
![]()
![]() +H+,其Ka=6.25×10-5,苯甲酸钠(
+H+,其Ka=6.25×10-5,苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,H2CO3的Ka1=4.17×l0-7,Ka2=4.90×l0-11。在生产碳酸饮料的过程中,除了添加NaA外, 还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,H2CO3的Ka1=4.17×l0-7,Ka2=4.90×l0-11。在生产碳酸饮料的过程中,除了添加NaA外, 还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
A. H2CO3的电离方程式为 H2CO3![]() 2H++CO32-
2H++CO32-
B. 提高CO2充气压力,饮料中c(A-)不变
C. 当pH为5.0时,饮料中 =0.16
=0.16
D. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,充分燃烧一定量的丁烷放出热量161.9kJ,经测定完全吸收生成的CO2需消耗5mol/L的KOH溶液100ml,恰好生成正盐,则此条件下热化学方程式:C4H10(g)+![]() O2(g)→4CO2(g)+5H2O(g)的△H为( )
O2(g)→4CO2(g)+5H2O(g)的△H为( )
A. +2590.4kJ/mol B. ﹣2590.4kJ/mol C. +1295.2kJ/mol D. ﹣1295.2kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com