
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 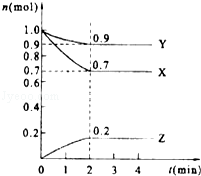
(1)当反应进行到第min,该反应达到平衡.
(2)反应从开始至2分钟末,用X的浓度变化表示的平均反应速率为v(X)=
(3)Y的转化率是
(4)由图中所给数据进行分析,该反应的化学方程为 .
【答案】
(1)2
(2)0.075mol/(L*min)
(3)10%
(4)3X+Y?2Z
【解析】解:(1)根据曲线的变化特点判断达到平衡的时间,达平衡时各物质的量不变,由图可知:2min时,该反应达到平衡,所以答案是:2;(2)根据v= ![]() =
= ![]() =0.075mol/(L*min),所以答案是:0.075mol/(L*min);(3)Y的转化率是
=0.075mol/(L*min),所以答案是:0.075mol/(L*min);(3)Y的转化率是 ![]() =
= ![]() =10%,所以答案是:10%;(4)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,Z的生成的物质的量为0.2 mol,因此三者比例为3:1:2,物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y2Z,所以答案是:3X+Y2Z.
=10%,所以答案是:10%;(4)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,Z的生成的物质的量为0.2 mol,因此三者比例为3:1:2,物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y2Z,所以答案是:3X+Y2Z.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式___________。
(4)完成以下氧化还原反应的离子方程式:
(______)MnO4-+(______)C2O42-+______=(______)Mn2++(______)CO2↑+________。
Ⅱ.SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如图:
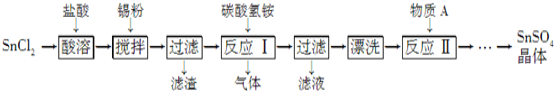
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+;SnCl2能水解生成碱式氯化亚锡。
(1)写出物质A的名称:_____。
(2)SnCl2用盐酸而不用水溶解的原因是___________(用化学方程式表示)。
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式: _________。
(4)反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:___________________。 该反应的温度需要控制在75 ℃左右的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同。下列说法错误的是( )
A. 单质的沸点:Z>W
B. 简单离子半径:X>W
C. 元素X与氧可形成既含离子键也含非极性共价键的化合物
D. X、Y、Z的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 乙酸和乙醇均能与NaOH溶液反应
B. CH3CH(CH3)2可称为异丁烷
C. 苯使溴水褪色是因为发生了取代反应
D. C3H6ClBr有4种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效环保的自来水消毒剂,其中氯和氧的化合价分别为( )
A. +4、-2 B. +2、-2 C. -2、-1 D. -4、+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将10 mL pH=1的CH3COOH加水稀释至100 mL后,溶液的pH为( )
A. 2
B. 2<pH<7
C. 1<pH<2
D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 蔗糖、果糖和麦芽糖均为双糖
B. 商代后期铸造出工艺精湛的司母戊鼎,该鼎属于铜合金制品
C. 植物油含不饱和脂肪酸酯,能使Br/CCl4褪色
D. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类。以下是一组对“一些物质与水反应”的分类图,请按要求填空:

(1)上述分类中,分成A、B两组的依据是___________________________;
(2)C组物质与水反应的离子方程式为_______________________________
(3)D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶1的物质有____(填化学式)。
(4)E组中________(填化学式)是大气主要污染物之一,易形成酸雨。
(5)实验室由Al3+制备Al(OH)3时,应选择F组中________(填化学式)的水溶液,离子方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com