
【题目】常温下,向50mL溶有0.1molCl2的氯水中滴加2mol·L-1的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如图所示。下列说法正确的是( )
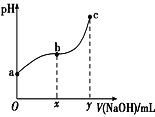
A.a点溶液中存在:N(HClO)+N(Cl-)+N(ClO-)=0.2NA(N表示粒子数),若想增加a点溶液的漂白能力可向溶液中加入碳酸钙固体
B.若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=![]()
C.b~c段,随NaOH溶液的滴入,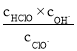 逐渐增大
逐渐增大
D.若y=200,则c点对应溶液中:c(HClO)+c(H+)=c(OH-)-2c(Cl-)
【答案】D
【解析】
整个过程先后发生的反应为Cl2+H2O![]() HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O.
HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O.
A.a点溶液中存在末反应的氯分子:N(HClO)+N(Cl-)+N(ClO-)<0.2NA(N表示粒子数),故A错误;
B.若a点pH=4,c(H+)=10-4mol·L-1,溶液呈酸性,根据方程式知c(HClO)=c(Cl-)-c(ClO-),c(Cl-)=m c(ClO-),则c(HClO)=(m-1)c(ClO-),Ka(HClO)=![]() ,则Ka(HClO)=
,则Ka(HClO)=![]() ,故B错误;
,故B错误;
C.b~c段,Cl2恰好与NaOH溶液生成NaCl、NaClO,随NaOH溶液的滴入,NaOH抑制NaClO水解:ClO-+H2O![]() HClO+OH-,c(HClO)减小,c(ClO-)增大,但水解常数只受温度影响,温度不变,水解常数
HClO+OH-,c(HClO)减小,c(ClO-)增大,但水解常数只受温度影响,温度不变,水解常数![]() 不变,故C错误;
不变,故C错误;
D.若y=200,c点对应溶液中存在0.1molNaCl、0.1molNaClO、0.2molNaOH,根据电荷守恒得:c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-)①,氯元素守恒得:c(Cl-)=c(ClO-)+c(HClO) ②,2c(Cl-)+2c(ClO-)+2c(HClO)=c(Na+)③,由①+③+②得:c(HClO)+c(H+)=c(OH-)-2c(Cl-),故D正确;
故选D。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
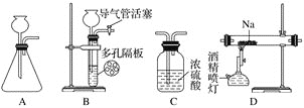
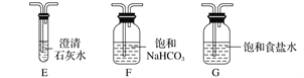
请回答下列问题:
(1)选择必要的仪器,按________顺序连接好装置(填装置序号)。
(2)检验装置B气密性的方法:_____________。
(3)实验时,在点燃酒精喷灯前必须进行的操作是________,待装置E中出现____现象时,再点燃酒精喷灯,以上操作的目的是____________。
(4)加热一段时间后观察到钠块表面变黑,继续加热后,钠燃烧,有白烟生成。两种产物中有一种是重要的化工原料,在玻璃工业中用量很大。则钠与二氧化碳反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2gCu与过量的8mol/L 40mL HNO3反应,硝酸的还原产物为NO2和NO,(体积变化忽略不计)反应结束后测得溶液中c(H+)为4 mol/L,则溶液中所含c(NO3-)为
A.4 mol/LB.5.6 mol/LC.6.5 mol/LD.6.3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列几种物质:A.石墨和C60;B.35Cl和37Cl;C.CH3CH=CHCH3和(CH3)2C=CH2;D.![]() 和
和![]() ;E.间二甲苯和异丙苯,请把合适字母填入以下横线里:属于同分异构体的是____;属于同系物的是____;属于同种物质的是______。
;E.间二甲苯和异丙苯,请把合适字母填入以下横线里:属于同分异构体的是____;属于同系物的是____;属于同种物质的是______。
(2)Dieis-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是: ![]() ,而
,而![]() 是由A(C5H6)和B经Dieis-Alder反应制得。写出A的结构简式:_______。
是由A(C5H6)和B经Dieis-Alder反应制得。写出A的结构简式:_______。
(3)如图是某药物中间体(仅含C、H、O三种元素)的结构示意图:
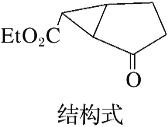
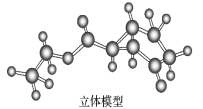
试回答下列问题:
①观察上面的键线式结构式与立体模型,通过对比指出结构式中的“Et”表示______(填名称);该药物中间体分子的化学式为______。
②现有一种芳香族化合物与该药物中间体互为同分异构体,其分子中共有三种不同类型的氢原子,试写出该化合物的结构简式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是( )
A.螺[3,3]庚烷(![]() )的二氯代物共有2种(不含立体异构)
)的二氯代物共有2种(不含立体异构)
B.乙烯和丙烯加成聚合最多可形成2种有机高分子化合物
C.对甲基苯乙烯分子中最多有17个原子共面
D.用氢氧化钠溶液无法鉴别矿物油和植物油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A(g)+2B(g)![]() 2C(g),达到平衡状态的标志
2C(g),达到平衡状态的标志
A.A的分解速率和C的生成速率比为1:2
B.单位时间内生成n mol A的同时生成2n mol B
C.A、B的物质的量比为1:2
D.A、B、C的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯化反应是酸与醇发生反应生成酯和水的反应。下列反应属于酯化反应的是( )
A. CH3COOH+NaOH→CH3COONa+H2O
B. CH2==CHCOOCH3+H2![]() CH3CH2COOCH3
CH3CH2COOCH3
C. CH3COOCH2CH3+H2O![]() CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH
D. 2CH3COOH+HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3+2H2O
CH3COOCH2CH2OOCCH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)高铁酸钠(Na2FeO4)可作为高效、多功能水处理剂,其摩尔质量是__________。高铁酸钠可与水反应生成Fe(OH)3胶体、氢氧化钠和氧气,写出相应的离子方程式:_____________。
(2)戴维通过电解法首先制得了金属钠,随后几十年内,工业上采用铁粉和氢氧化钠高温熔融的方法制得钠蒸气,同时获得Fe3O4和氢气。写出该反应的化学方程式_____________,该反应中属于电解质但不属于氧化物的物质是________________(填化学式),若制得22.4L(折算为标准状况下)钠蒸气,转移电子的数目为________________。
(3)漂白粉常用于饮水、污水、排泄物及被污染的环境消毒,其主要成分是氯化钙和次氯酸钙[Ca(ClO)2],有效成分为次氯酸钙。为测得某漂白粉的有效成分含量,称取A g漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,若反应生成次氯酸(HClO)的物质的量为Kmol,则该漂白粉中有效成分的质量分数为___________%(用含A、K的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(![]() )材料具有低的热产生率和高的击穿电场,是制造大功率和高频微波电子器件的理想半导体材料。
)材料具有低的热产生率和高的击穿电场,是制造大功率和高频微波电子器件的理想半导体材料。
已知:①Ga和Al同主族且相邻,化学性质与铝相似;②在室温下,氮化镓不溶于水,硬度高,熔点高,能与热的碱溶液缓慢反应。
(1)配平氮化镓制备的化学方程式:□Ga(l)+□NH3(g)□GaN(s)+□H2(g)+QkJ(Q>0)_____________
(2)上述反应的平衡常数表达式K=_____________;在恒温恒容密闭容器中制备氮化镓,下列有关说法正确的是_____________
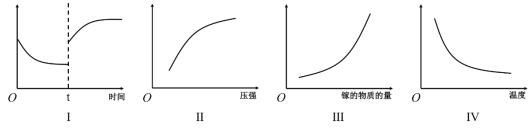
A.Ⅰ图像中如果纵坐标为正反应速率,则t时刻改变的条件可能是加压
B.Ⅱ图像中纵坐标可以为镓的转化率
C.Ⅲ图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为平衡常数
(3)Ga最外层电子的核外电子排布式___________________,N核外能量最高的电子亚层上电子云空间伸展方向有_____________种;
(4)氮化镓的晶体类型_____________,氮化铝和氮化镓晶体类型相同,且结构相似,比较两者熔点的高低并解释原因_____________________________________________________________;
(5)写出氮化镓溶于热的NaOH溶液的离子方程式____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com