
【题目】常温下将NaOH 溶液滴加到H2X 溶液中,混合溶液的pH与 、
、 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A. H2X 为二元强酸
B. 当 = 1时,溶液中c(HX-)=c(H2X)
= 1时,溶液中c(HX-)=c(H2X)
C. NaHX 溶液中c(H+)-)
D. 当溶液pH=4.6 时c(HX-)>c(X2-)
科目:高中化学 来源: 题型:
【题目】A,B两种液态有机物均由碳、氢、氧三种元素组成。A能溶于水,它的相对分子质量是60,分子中有8个原子,其中氧原子数与碳原子数相等,且A与碳酸钠溶液混合时冒气泡。B分子中有9个原子,分子内所有原子的核电荷数之和为26,且B只能跟钠反应放出氢气,不能与碳酸钠溶液反应。
(1)A的结构简式为 __________________ ,B的结构简式为 ________________。
(2)写出A与碳酸钠溶液反应的化学方程式________________________________。
(3)写出B与钠反应的化学方程式_____________________________。
(4)写出A与B反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物有着优异的性能和广泛的应用。工业上利用铅浮渣(主要成分是PbO、Pb,还含有少量的Ag、CaO)制备硫酸铅。制备流程图如下
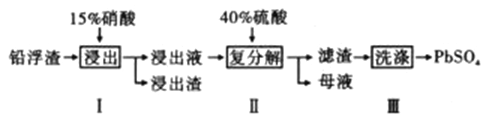
已知:Ksp(PbSO4)=1.6×10-8 Ksp(CaSO4)=4.9×10-5
(1)步骤I有NO产生浸出液中含量最多的金属阳离子为Pb2+,写出Pb参加反应的化学方程式___________________________,为防止Ag被溶解进入溶液,步骤I操作时应注意_______________________。
(2)粗PbSO4产品含有的杂质是____________;要得到纯净的PbSO4,需要用试剂进行多次洗涤,再用蒸馏水洗涤。最好选用的试剂是_________________。
A.稀硫酸 B.稀盐酸 C.硝酸铅溶液 D.酒精
(3)母液可循环利用的物质是HNO3,若母液中残留的SO42-过多,循环利用时可能出现的问题是______________________________。
(4)若将步骤Ⅱ中的Pb2+完全沉淀,则溶液中的c(SO42-)至少为___________mol/L。
(5)(CH3COO)2Pb是皮毛行业可溶于水的染色助剂,可用PbSO4与CH3 COONH4反应制备,写出该反应的离子方程式_______________________。
(6)铅蓄电池是电压稳定、使用方便的二次电池。PbSO4在其中扮演了重要角色,写出铅蓄电池充电时阳极的电极反应_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从100 mL 0.3 mol/L AlCl3溶液中取出10mL,则取出溶液中Cl-物质的量浓度是( )
A.0.3 mol/LB.0.03 mol/LC.0.9 mol/LD.0.09 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
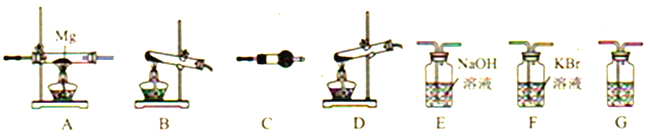
(1)写出高氯酸铵分解的化学方程式__________。
(2)高氯酸铵分解选择的装置是__________(填字母)。
(3)按气流从左到右,装置的连接顺序是:分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________。
(7)某实验宣存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物实验中,可以根据与某些化学试剂所产生的颜色反应,检测生物组织中的有关有机化合物的存在。在下列实验列表中,正确的是( )
选项 | 待检测的物质 | 使用试剂 | 呈现颜色 |
A | 苹果中的还原糖 | 斐林试剂 | 橘黄色 |
B | 马铃薯中的淀粉 | 双缩脲试剂 | 蓝色 |
C | 花生的脂肪 | 苏丹Ⅲ染液 | 橘黄色 |
D | 大豆中的蛋白质 | 斐林试剂 | 紫色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能溶于浓硫酸,能漂白某些有机染料,如品红等。回答下列问题:

(1)甲组同学按照上图所示装置,通过实验检验绿矾分解产物。装置B中可观察到的现象是______________________________,甲组由此得出绿矾的分解产物中含有SO2。
(2)乙组同学认为上述实验结论不严谨,对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中____________(填字母)。
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分实验装置及下列装置重新组装,对绿矾分解所得气态产物进行进一步验证: 
①装置F中仪器的名称是______________________。
②丙组同学的实验装置中,依次连接的合理顺序为A、F、____、____、____、D、H(每个仪器只能使用一次)。该实验过程中,SO3对后面气体检测不产生干扰的现象是____________。
③实验完成后,A试管中产生的红色固体是_________。能证明绿矾分解产物中有O2的检验方法是______________________________________________________。
④已知实验前装置A试管中所取的绿矾质量是mg,加热一段时间后,往该试管中加入足量的稀硫酸,并用浓度为c mol/L的KMnO4溶液滴定,到达滴定终点时,消耗KMnO4溶液的体积为VmL,则绿矾加热分解过程中,铁元素被氧化的百分率为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com