
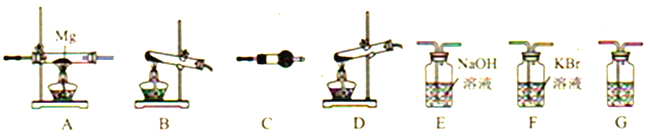
【题目】高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
(1)写出高氯酸铵分解的化学方程式__________。
(2)高氯酸铵分解选择的装置是__________(填字母)。
(3)按气流从左到右,装置的连接顺序是:分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________。
(7)某实验宣存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________。

【答案】 2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O B CFEGA 无水CuSO4 吸收水(干燥) F中溶液由无色变为橙色(或黄色) 取少量A中反应后的固体于试管中,加水,将湿润的红色石蕊试纸放在试管口,试纸变蓝色 94%
N2↑+2O2↑+Cl2↑+4H2O B CFEGA 无水CuSO4 吸收水(干燥) F中溶液由无色变为橙色(或黄色) 取少量A中反应后的固体于试管中,加水,将湿润的红色石蕊试纸放在试管口,试纸变蓝色 94%
【解析】(1) NH4CIO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;反应的化学方程式:2NH4ClO4![]() N2 ↑+2O2↑+Cl2 ↑+4H2O ;正确答案:2NH4ClO4
N2 ↑+2O2↑+Cl2 ↑+4H2O ;正确答案:2NH4ClO4![]() N2 ↑+2O2↑+Cl2 ↑+4H2O。
N2 ↑+2O2↑+Cl2 ↑+4H2O。
(2) 高氯酸铵为固体,且有水产生,因此要用到固+固加热装置,正确答案:B。
(3) 高氯酸铵分解产物中N2、Cl2、O2、H2O;先通过装置C验证水蒸气,然后进入装置F中验证氯气,然后气体进入装置E中,除去氯气,G中装有浓硫酸,进行气体的干燥;最后氮气与镁反应生成氮化镁;装置的连接顺序是:分解装置→C→F→E→G→A;
(4)根据上述分析可知C中所放的试剂是无水CuSO4,检验水蒸气;G中装有浓硫酸,吸收水蒸气;正确答案:无水CuSO4;吸收水。
(5)氯气有氧化性,能够把溴离子氧化为溴单质, F中溶液由无色变为橙色(或黄色),能证明有Cl2产生;正确答案:F中溶液由无色变为橙色(或黄色)。
(6) Mg3N2易水解,与水发生反应生成氢氧化镁和氨气,因此只要检验氨气的存在即可证明装置A中生成了Mg3N2;具体操作为取少量A中反应后的固体于试管中,加水,将湿润的红色石蕊试纸放在试管口,试纸变蓝色;正确答案:取少量A中反应后的固体于试管中,加水,将湿润的红色石蕊试纸放在试管口,试纸变蓝色。
(7) NH4ClO4与氢氧化钠反应生成氨气,氨气被过量的硫酸吸收变为硫酸铵,剩余的硫酸用氢氧化钠溶液进行滴定,因此根据酸碱中和规律:溶液中剩余的氢离子的量等于消耗氢氧化钠的量=1×20×10-3=0.02mol,所以用来吸收氨气的氢离子的量为30×1×2 ×10-3-0.02=0.04 mol,所以氨气的量=0.04 mol,高氯酸铵的量=0.04 mol,高氯酸铵的质量=0.04×117.5=4.7g,所以则样品中NH4ClO4的含量(w)为4.7/5×100%=94%;正确答案:94%。


 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A. 单位时间内生成nmolA2同时生成nmolAB
B. 单位时间内生成2nmolAB的同时生成nmolB2
C. 容器内的总物质的量不随时间变化
D. 单位时间内断开1molA-A键的同时生成2molA-B键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 通过石油的分馏,可直接得到乙烯、丙烯等有机化工原料
B. 煤在空气中加强热得到焦炭等产品的过程叫做煤的干馏
C. 加热杀死流感H7N9病毒是因为其蛋白质受热发生盐析
D. ![]() 和
和![]() 是同种物质,可证明苯分子中不存在单、双键交替的结构
是同种物质,可证明苯分子中不存在单、双键交替的结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH 溶液滴加到H2X 溶液中,混合溶液的pH与 、
、 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A. H2X 为二元强酸
B. 当 = 1时,溶液中c(HX-)=c(H2X)
= 1时,溶液中c(HX-)=c(H2X)
C. NaHX 溶液中c(H+)-)
D. 当溶液pH=4.6 时c(HX-)>c(X2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种植物生长的调节剂,A进行下图所示的转化可制得有果香味的液体E(C4H8O2)。请回答下列问题:
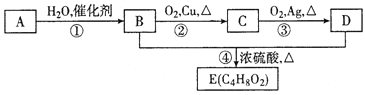
(1)A的电子式为______,D分子中所含官能团的名称为_______。
(2)④的反应类型是___________。
(3)A在一定条件下可以聚生成一种常见塑料,写出该塑料的结构简式_______。
(4)请写出有机物E与NaOH溶液反应的化学方程式______。
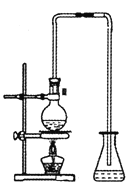
(5)实验室出反应④制备有机物E的装置如下图,长导管的作用是导气和________,锥形瓶中盛放的液体是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。下列叙述中错误的是

A. 电池工作时负极材料是Li,发生氧化反应
B. 将电解质溶液改为LiCl的水溶液,电池性能会更好
C. 电池工作时电子流向:锂电极→导线→负载→碳棒
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e=2Cl+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( ) 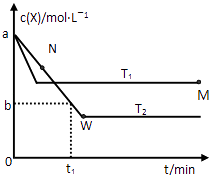
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= ![]() molL﹣1min﹣1
molL﹣1min﹣1
C.M点的正反应速率V正大于N点的逆反应速率V逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草木灰的有效成分是K2CO3,还含有少量的Na+、Cl-、SO42-和大量不溶于水的固体。为测定其中K2CO3的含量,设计如下实验:

完成下列填空:
(1)洗涤滤渣的目的是_____________________________________。
(2)配制100 mL草木灰浸出液,需要使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、______。
(3)取用10.00 mL浸出液进行滴定,终点时溶液由______色变成______色。若三次平行实验消耗硫酸体积的平均值为25.00 mL,则该样品中碳酸钾的质量分数为______(精确到小数点后3位)。
(4)若没有用标准液润洗滴定管,则实验结果将___(填“偏大”、“偏小”或“无影响”)。
(5)利用如图装置,通过反应前后总质量的改变,确定CO2气体的质量,也可以测定样品中碳酸钾的含量。实验时发生反应的离子方程式为_______________________。判断反应完全的依据是_____________________。请对该实验方案的优缺点进行评价。________________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com