
【题目】阿司匹林也叫乙酰水杨酸,是百年来三大经典药物之一.用于治感冒、发热、头痛、牙痛、关节痛、风湿病,还能抑制血小板聚集,用于预防和治疗缺血性心脏病、心绞痛、心肺梗塞、脑血栓形成,也可应用于血管形成术及旁路移植术.阿司匹林经典的合成方法如下流程:
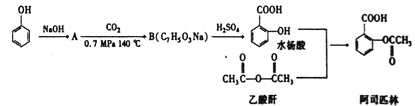
回答下列问題:
(1)阿司匹林的分子式为 ______ ,分子中所含官能团为 ______ 、 ______ ;水杨酸的系统命名为 ______。
(2)水杨酸和乙酸酐生成阿司匹林的反应类型属于 ______ ,反应过程中控制温度在![]() ,若温度过高易发生期反应,可能生成的副产物中属于脂的为 ______
,若温度过高易发生期反应,可能生成的副产物中属于脂的为 ______ ![]() 写出两种物质的结构简式,毎个分子中只有两个环
写出两种物质的结构简式,毎个分子中只有两个环![]() 。
。
(3)![]() 生成B的反应方程式为 ______ ,阿司匹林与足量的NaOH溶液反应的化学方程式为 ______ 。
生成B的反应方程式为 ______ ,阿司匹林与足量的NaOH溶液反应的化学方程式为 ______ 。
(4)水杨酸有多种同分异构体,符合下列条件的芳香族化合物有 ______ 种。
①能发生银镜反应②三氯化铁溶液呈紫色。
(5)苯酚也有多种同分异构体,写出其核磁共振氢谱只有一种的物质的结构简式 ____。
【答案】![]() 酯基 羧基
酯基 羧基 ![]() 羟基苯甲酸 取代反应
羟基苯甲酸 取代反应 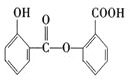
![]() +CO2
+CO2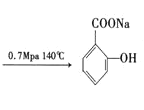
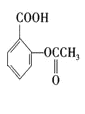 +3NaOH→
+3NaOH→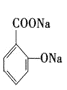 +CH3COONa+2H2O 9
+CH3COONa+2H2O 9 ![]()
【解析】
⑴由阿司匹林的结构简式书写其分子式,可知其含有的官能团有酯基、羧基;水杨酸中连接羟基的碳原子为2号碳,苯甲酸为母体。
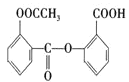
⑵对比水杨酸、乙酸酐与阿司匹林的结构可知,水杨酸与乙酸酐发生取代反应生成阿司匹林,同时还有![]() 生成;若温度过高易发生副反应,可能生成的副产物中属于脂,可以是水杨酸中羧基与另一分子水杨酸中羟基反应生成酯,也可以是阿司匹林中羧基与水杨酸中羟基形成酯。
生成;若温度过高易发生副反应,可能生成的副产物中属于脂,可以是水杨酸中羧基与另一分子水杨酸中羟基反应生成酯,也可以是阿司匹林中羧基与水杨酸中羟基形成酯。
⑶苯酚与氢氧化钠反应生成A为![]() ,A与二氧化碳再一定条件下得到B,B与硫酸反应得到水杨酸,结合B的分子式与水杨酸结构可知B为
,A与二氧化碳再一定条件下得到B,B与硫酸反应得到水杨酸,结合B的分子式与水杨酸结构可知B为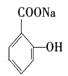 ;阿司匹林水解得到
;阿司匹林水解得到![]() 与乙酸,
与乙酸,![]() 中羧基、酚羟基及乙酸均与NaOH发生中和反应。
中羧基、酚羟基及乙酸均与NaOH发生中和反应。
⑷水杨酸有多种同分异构体,符合下列条件的芳香族化合物:![]() 能发生银镜反应,含有
能发生银镜反应,含有![]() ;
;![]() 三氯化铁溶液呈紫色,含有酚羟基,则侧链为
三氯化铁溶液呈紫色,含有酚羟基,则侧链为![]() 、
、![]() ,有邻、间、对三种位置,可以有2个
,有邻、间、对三种位置,可以有2个![]() 、1个
、1个![]() ,先确定2个
,先确定2个![]() 位置,再移动
位置,再移动![]() 位置,判断同分异构体数目;苯酚也有多种同分异构体,其中核磁共振氢谱只有一种,为对称结构,该同分异构体为
位置,判断同分异构体数目;苯酚也有多种同分异构体,其中核磁共振氢谱只有一种,为对称结构,该同分异构体为![]() 。
。
⑴由阿司匹林的结构简式,可知其分子式为![]() ,可知其含有的官能团有酯基、羧基;水杨酸中连接羟基的碳原子为2号碳,苯甲酸为母体,系统命名为:
,可知其含有的官能团有酯基、羧基;水杨酸中连接羟基的碳原子为2号碳,苯甲酸为母体,系统命名为:![]() 羟基苯甲酸;故答案为:
羟基苯甲酸;故答案为:![]() ;酯基、羧基;
;酯基、羧基;![]() 羟基苯甲酸。
羟基苯甲酸。
⑵对比水杨酸、乙酸酐与阿司匹林的结构可知,水杨酸与乙酸酐发生取代反应生成阿司匹林,同时还有![]() 生成;若温度过高易发生副反应,可能生成的副产物中属于脂,可以是水杨酸中羧基与另一分子水杨酸中羟基反应生成酯,结构简式为
生成;若温度过高易发生副反应,可能生成的副产物中属于脂,可以是水杨酸中羧基与另一分子水杨酸中羟基反应生成酯,结构简式为 ,也可以是阿司匹林中羧基与水杨酸中羟基形成酯,结构简式为:
,也可以是阿司匹林中羧基与水杨酸中羟基形成酯,结构简式为: ;故答案为:取代反应;
;故答案为:取代反应; 、
、 。
。
⑶苯酚与氢氧化钠反应生成A为![]() ,A与二氧化碳再一定条件下得到B,B与硫酸反应得到水杨酸,结合B的分子式与水杨酸结构可知B为
,A与二氧化碳再一定条件下得到B,B与硫酸反应得到水杨酸,结合B的分子式与水杨酸结构可知B为 ,A生成B的反应方程式为:
,A生成B的反应方程式为: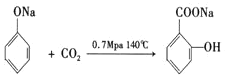 ;阿司匹林水解得到
;阿司匹林水解得到![]() 与乙酸,
与乙酸,![]() 中羧基、酚羟基及乙酸均与NaOH发生中和反应,阿司匹林与足量的NaOH溶液反应的化学方程式为:
中羧基、酚羟基及乙酸均与NaOH发生中和反应,阿司匹林与足量的NaOH溶液反应的化学方程式为: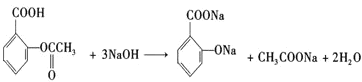 ;故答案为:
;故答案为: ;
; 。
。
⑷水杨酸有多种同分异构体,符合下列条件的芳香族化合物:![]() 能发生银镜反应,含有
能发生银镜反应,含有![]() ;
;![]() 三氯化铁溶液呈紫色,含有酚羟基,则侧链为
三氯化铁溶液呈紫色,含有酚羟基,则侧链为![]() 、
、![]() ,有邻、间、对三种位置,可以有2个
,有邻、间、对三种位置,可以有2个![]() 、1个
、1个![]() ,2个
,2个![]() 处于邻位,
处于邻位,![]() 有2种位置,2个
有2种位置,2个![]() 处于间位,
处于间位,![]() 有3种位置,2个
有3种位置,2个![]() 处于对位,
处于对位,![]() 有1种位置,故共有
有1种位置,故共有![]() 种;苯酚也有多种同分异构体,其中核磁共振氢谱只有一种,该同分异构体为对称结构,该同分异构体为
种;苯酚也有多种同分异构体,其中核磁共振氢谱只有一种,该同分异构体为对称结构,该同分异构体为![]() ;故答案为:9;
;故答案为:9;![]() 。
。


科目:高中化学 来源: 题型:
【题目】(I)研究大气中含硫化合物(主要是 SO2 和 H2S)的转化具有重要意义。
(1)工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离H2,发生的反应为: 2H2S(g) ![]() 2H2(g)+S2(g) ΔH
2H2(g)+S2(g) ΔH
已知:①H2S(g) ![]() H2(g)+S(g) ΔH1; ②2S(g)
H2(g)+S(g) ΔH1; ②2S(g) ![]() S2(g) ΔH2。
S2(g) ΔH2。
则 ΔH=________________(用含 ΔH1、ΔH2的式子表示)。
(2)土壤中的微生物可将大气中 H2S 经两步反应氧化成 SO42-,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为________________。
(II)100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N2O4,发生反应:N2O4(g) ![]() 2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
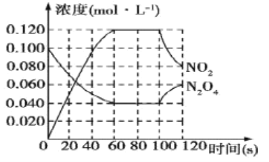
(3)在0~60s内,以N2O4表示的平均反应速率为__________mol·L-1·s-1。
(4)根据图中有关数据,计算100℃时该反应的平衡常数K1=__________。若其他条件不变,升高温度至120℃,达到新平衡时的平衡常数是K2,则K1_____K2(填“>”、“<”或“=”)。
(III)向容积为2L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g)。
H2(g)+CO2(g)。
(5)下列说法能作为判断该反应达到化学平衡状态的依据的是____(填字母序号)。
A.容器内CO、H2O、CO2、H2的浓度之比为1:1:1:1
B.CO的消耗速率与H2的消耗速率相等
C.容器内压强保持不变
D.混合气体的密度保持不变
(6)保持其他条件不变:在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=______。(精确到小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 检验KIO3中的碘元素 | 取少量KIO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 |
B | 检验石油裂解气中的乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
C | 比较HClO和CH3COOH的酸性强弱 | 室温下,用pH计测定饱和的NaClO溶液和饱和的 |
D | 硅酸胶体的制备 | 向 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于H2(g)+I2(g)![]() 2HI(g),ΔH<0,根据如图,下列说法错误的是( )
2HI(g),ΔH<0,根据如图,下列说法错误的是( )
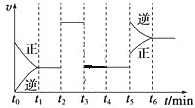
A.t2时可能使用了催化剂B.t3时可能采取减小反应体系压强的措施
C.t5时采取升温的措施D.反应在t6时刻,HI体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
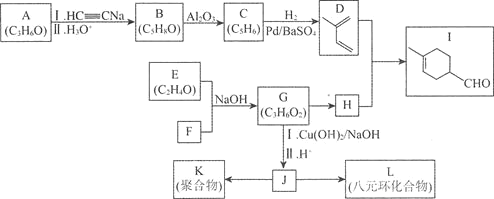
【题目】已知:A是石油裂解气的主要成份,医学上曾用类似G与新制氢氧化铜悬浊液的反应检验糖尿病;E是一种具有香味的物质,各物质间的转化如下图所示![]() 部分反应条件和产物已略去
部分反应条件和产物已略去![]() 。
。
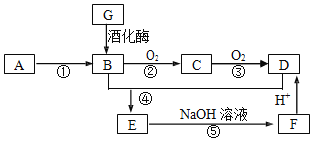
请回答下列问题:
(1)![]() 的结构简式为______
的结构简式为______
(2)写出下列反应的反应类型:![]() ______,
______,![]() ______
______
(3)写出E生成F的反应的离子方程式______
(4)下列说法正确的是______
A. 有机物B、C和D都可以与金属钠反应
B. 用新制的氢氧化铜悬浊液可以鉴别B、C、D
C. E的同分异构体中与E具有相同官能团的有三种(不包括E)
D. G是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是甲、乙、丙、丁、戊五种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液退色;②比例模型为 |
乙 | ①由C、H两种元素组成;②球棍模型为 |
丙 | ①由C、H、O三种元素组成;②能与Na反应,但不能与 |
丁 | ①相对分子质量比丙少;②能由丙氧化而成 |
戊 | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应所得产物的名称是___________________。
(2)甲与氢气发生加成反应后生成物质己,在己在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式![]() 。当
。当![]() ___________________时,这类有机物开始出现同分异构体。
___________________时,这类有机物开始出现同分异构体。
(3)乙具有的性质是___________________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性![]() 溶液和溴水反应而使其退色 ⑥任何条件下都不与氢气反应
溶液和溴水反应而使其退色 ⑥任何条件下都不与氢气反应
(4)丙与戊反应能生成相对分子质量为100的酯,所发生反应的反应类型为_____________________,对应的化学方程式为_______________________。
(5)写出丙氧化生成丁的化学反应方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是有机合成中的一种重要中间体,其合成路线如下所示![]() 部分产物及条件略去
部分产物及条件略去![]() 。
。
已知:
①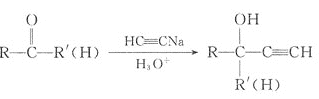 ;
;
②![]()
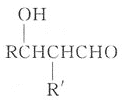
③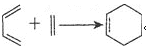
④A的一氯代物只有一种。
![]() Ⅰ分子中所含官能团的名称为________。
Ⅰ分子中所含官能团的名称为________。
![]() 中过程Ⅰ的反应类型为________,
中过程Ⅰ的反应类型为________,![]() 的反应类型为________。
的反应类型为________。
![]() 的化学名称为________________。
的化学名称为________________。
![]() 的结构简式为________________,L的结构简式为________________。
的结构简式为________________,L的结构简式为________________。
![]() 中过程Ⅰ的化学方程式为________________________。
中过程Ⅰ的化学方程式为________________________。
![]() 同时满足下列条件的Ⅰ的同分异构体有________种
同时满足下列条件的Ⅰ的同分异构体有________种![]() 不考虑立体异构,不包括Ⅰ
不考虑立体异构,不包括Ⅰ![]() 。
。
![]() 具有六元碳环结构
具有六元碳环结构
![]() 分子中含有一个甲基
分子中含有一个甲基
![]() 与Ⅰ具有相同的官能团
与Ⅰ具有相同的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火电厂粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。某研究小组对其进行综合处理的流程如图所示:
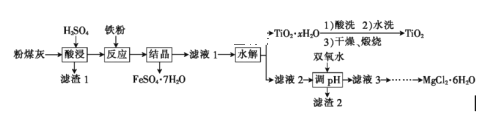
已知:①“酸浸”后钛主要以TiOSO4的形式存在,强电解质TiOSO4在溶液中仅能电离出SO42-和TiO2+,TiO2+在80℃左右水解生成TiO2·xH2O。
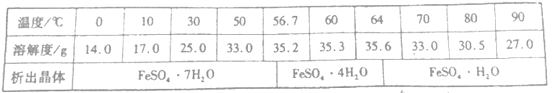
②已知FeSO4在不同温度下的溶解度和析出晶体的组成如下表:
回答下列问题:
(1)加快“酸浸”速率的措施有哪些?写出一条即可___,滤渣1的主要成分为___(填化学式)。
(2)“反应”时加入铁粉的作用为___(用离子方程式表示)。
(3)“结晶”时,若要获得FeSO4·7H2O,则对溶液进行的操作是:蒸发浓缩,___,过滤,洗涤,干燥。
(4)“水解”反应的离子方程式为____。
(5)实验室用MgCl2·6H2O制备MgCl2固体,在加热的同时要不断通入___(填化学式,下同)若不通入该物质,最终得到的产物中可能含有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
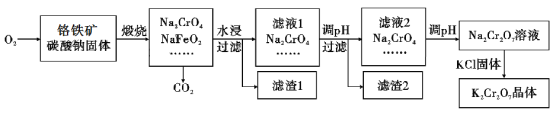
【题目】重铬酸钾(K2Cr2O7)为用途极广的铬化合物,供制铬矾。火柴、铬颜料、并供鞣革、电镀、有机合成等用。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程如图所示:
根据题意回答下列问题:
(1)锻烧时,铬铁矿发生复杂反应生成Na2CrO4和NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式是___。
(2)NaFeO2遇水强烈水解生成滤渣l的反应离子方程式是___。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7-8目的是___,滤液2调节pH约为5目的是___。
物质 | 溶解度/(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。此法能够制得K2Cr2O7晶体的原因是:___;为了从溶液中得到较多K2Cr2O7晶体的操作过程是:___、过滤、洗涤、干燥。将得到的K2Cr2O7晶体进一步纯化操作是:___。
(5)K2Cr2O7性质:往K2Cr2O7溶液中加入AgNO3溶液,生成一种砖红色沉淀、溶液的pH减小,反应离子方程式是___。
(6)K2Cr2O7产品含量测定:准确称取试样2.5g配成250mL溶液,用移液管吸取25.00mL溶液放入碘量瓶,加入10mL2mol/L硫酸、2gKI于暗处5min,另加100mL水,用0.2000mol/L Na2S2O3标准液滴定至溶液黄绿色,再加3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。平行三次实验,平均消耗Na2S2O3标准液的体积25.00mL。K2Cr2O7产品的纯度为___。
有关反应如下:K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+4K2SO4+3I2+7H2O
2Na2S2O3+I2=Na2S4O6+2NaI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com