
����Ŀ����糧��ú�ҵ���Ҫ�ɷ�ΪSiO2��Al2O3��FeO��Fe2O3��MgO��TiO2�ȡ�ij�о�С���������ۺϴ�����������ͼ��ʾ��
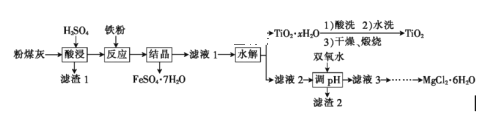
��֪�����������������Ҫ��TiOSO4����ʽ���ڣ�ǿ�����TiOSO4����Һ�н��ܵ����SO42-��TiO2+��TiO2+��80������ˮ������TiO2��xH2O��
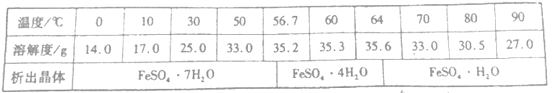
����֪FeSO4�ڲ�ͬ�¶��µ��ܽ�Ⱥ����������������±���
�ش��������⣺
��1���ӿ�����������ʵĴ�ʩ����Щ��д��һ������___������1����Ҫ�ɷ�Ϊ___(�ѧʽ)��
��2������Ӧ��ʱ�������۵�����Ϊ___�������ӷ���ʽ��ʾ����
��3�����ᾧ��ʱ����Ҫ���FeSO4��7H2O�������Һ���еIJ����ǣ�����Ũ����___�����ˣ�ϴ�ӣ����
��4����ˮ������Ӧ�����ӷ���ʽΪ____��
��5��ʵ������MgCl2��6H2O�Ʊ�MgCl2���壬�ڼ��ȵ�ͬʱҪ����ͨ��___(�ѧʽ����ͬ)����ͨ������ʣ����յõ��IJ����п��ܺ���___��
���𰸡��ȣ���ú�ҷ���ʯ�����У� SiO2 2Fe3++Fe=3Fe2+ ��ȴ��50�����½ᾧ TiO2++(x+1)H2O![]() TiO2��xH2O+2H+ HCl MgO��Mg��OH��Cl
TiO2��xH2O+2H+ HCl MgO��Mg��OH��Cl
��������
��ú�ҵ���Ҫ�ɷ�ΪSiO2��Al2O3��FeO��Fe2O3��MgO��TiO2�ȣ������������ܹ��˵õ�����1����Һ���������ܽ����������������������ܽ����������������������ܽ�����������������þ�ܽ���������þ���������������Ҫ��TiOSO4��ʽ���ڣ�����ΪSiO2���������ۻ�ԭ�����������������ӣ��ᾧ���������������壬���ˣ��õ���Һ1��������������þ��TiOSO4����������������ˮ����ˣ�TiOSO4����TiO2xH2O������ϴˮϴ��������պ�õ�TiO2����Һ2�к�������������þ���������������������������������������Ϊ�����ӣ�������ҺpHʹ�����Ӻ�������ȫ�����������˵õ�����2Ϊ��������������������������Һ3������þ���ݴ˷�����
��1���÷�ӦΪ��Һ��Ӧ����Ҫ�ӿ�������������ʣ���ͨ���������ѧ��Ӧ���ʣ�Ҳ�ɽ�ú�ҷ���ʯ�����У�����Ӧ�Ӵ���������ѧ��Ӧ���ʣ�������������֪��������ҪΪSiO2��
��2������Ҫ��Fe3+ת��ΪFe2+��FeSO4��7H2O�ᾧ��ȥ���ʼ������۵�Ŀ���ǽ�������ת��Ϊ�������������ӷ�Ӧ����ʽΪ��2Fe3++Fe=3Fe2+��
��3������ɱ����֪��FeSO4��50��������Ҫ��������ΪFeSO4��7H2O����Ҫ���FeSO4��7H2O�������Һ���еIJ����ǣ�����Ũ������ȴ��50�����½ᾧ�����ˣ�ϴ�ӣ����
��4��ˮ������У�TiOSO4����TiO2xH2O������ǿ�����TiOSO4����Һ�н��ܵ����SO42-��TiO2+��TiO2+��80������ˮ������TiO2��xH2O�����ʸ÷�Ӧ�����ӷ���ʽΪ��TiO2++(x+1)H2O![]() TiO2��xH2O+2H+��
TiO2��xH2O+2H+��
��5��MgCl2��6H2O�Ʊ�MgCl2���壬�ڼ��ȹ����У�MgCl2��Mg2+ˮ��̶��������ɵ�HCl����Ũ�����ӻ�����������������ù����к���MgO��Mg(OH)Cl������ڼ��ȵ�ͬʱҪ����ͨ��HCl���壬�Դ�����MgCl2��ˮ�⣬�Ӷ����MgCl2���塣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1��ͭпԭ���ʾ��ͼ��ͼ2�У�x���ʾʵ��ʱ���������ĵ��ӵ����ʵ�����y���ʾ��������

A. ͭ�������� B. c(Zn2��) C. c(H��) D. c(SO42-) -
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
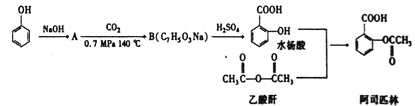
����Ŀ����˾ƥ��Ҳ������ˮ���ᣬ�ǰ���������ҩ��֮һ�������θ�ð�����ȡ�ͷʹ����ʹ���ؽ�ʹ����ʪ������������ѪС��ۼ�������Ԥ��������ȱѪ�����ಡ���Ľ�ʹ���ķι�������Ѫ˨�γɣ�Ҳ��Ӧ����Ѫ���γ�������·��ֲ������˾ƥ�־���ĺϳɷ����������̣�
�ش��������}��
(1)��˾ƥ�ֵķ���ʽΪ ______ ������������������Ϊ ______ �� ______ ��ˮ�����ϵͳ����Ϊ ______��
(2)ˮ��������������ɰ�˾ƥ�ֵķ�Ӧ�������� ______ ����Ӧ�����п����¶���![]() �����¶ȹ��������ڷ�Ӧ���������ɵĸ�����������֬��Ϊ ______
�����¶ȹ��������ڷ�Ӧ���������ɵĸ�����������֬��Ϊ ______ ![]() д���������ʵĽṹ��ʽ������������ֻ��������
д���������ʵĽṹ��ʽ������������ֻ��������![]() ��
��
(3)![]() ����B�ķ�Ӧ����ʽΪ ______ ����˾ƥ����������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ ______ ��
����B�ķ�Ӧ����ʽΪ ______ ����˾ƥ����������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ ______ ��
(4)ˮ�����ж���ͬ���칹�壬�������������ķ����廯������ ______ �֡�
���ܷ���������Ӧ�����Ȼ�����Һ����ɫ��
(5)����Ҳ�ж���ͬ���칹�壬д����˴Ź�������ֻ��һ�ֵ����ʵĽṹ��ʽ ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С������ϩ�ͼױ�Ϊ��Ҫԭ�ϣ���Ƴ�ҽҩ�м���G�ĺϳ�·�����£�

��֪��![]()
RCOOH![]() RCOCl
RCOCl![]() RCOOR��
RCOOR��
��1��B�Ľṹ��ʽΪ________��
��2������ϩ��������E��ת�������У��漰�ķ�Ӧ����������________��Ӧ��________��Ӧ��________��Ӧ��
��3��F�ķ���ʽΪ________��M��F��ij���ܷ���ˮ�ⷴӦ��ͬ���칹�壬���ⶨM�ĺ˴Ź�������Ϊ2����ҷ����֮��Ϊ2:3����M�Ľṹ��ʽ����Ϊ________![]() ��дһ�м���
��дһ�м���![]() ��д��M������NaOH��Һ��Ӧ����ѧ����ʽ��________��
��д��M������NaOH��Һ��Ӧ����ѧ����ʽ��________��
��4��A��ͬ���칹���ж��֣�ͬʱ��������������A��ͬ���칹����________�֡�
�ٺ���һ![]() ��
��![]() �Ҷ��뱽��ֱ��������
�Ҷ��뱽��ֱ��������
����4��̼ԭ����ͬһ��ֱ���ϡ�
��5����Ƴ��Լױ�Ϊԭ���Ʊ�A�ĺϳ�·��_____________�������Լ���ѡ����֪��RCHO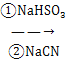
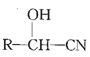 ���ϳ�·�߳��õı�ʾ��ʽΪ��ԭ��
���ϳ�·�߳��õı�ʾ��ʽΪ��ԭ�� �м����
�м���� Ŀ����
Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��5��ǧ�귱���Ĺų����ݿ�ͨ��������������־�Źų�������ʽ����������ʱ������������·�ڽ���ʩ����Ҫ����ʹ�ø��ֲ��ϣ�
������ˮ��Ͳ������õ���ԭ����______���Ʊ������ķ�Ӧ����ʽ______![]() ��дһ��
��дһ��![]() ��
��
�ڶ����������ΰ�Ķ����![]() ��̼����
��̼����![]() ��PC�Ͻ��ģ�PC����______
��PC�Ͻ��ģ�PC����______![]() ����ĸ
����ĸ![]() ��
��
![]() ��������
��������![]() ���ǽ�������
���ǽ�������![]() �л��߷��Ӳ���
�л��߷��Ӳ���
�۶�������ʹ�����Ͻ�����������ᣮ�����й����Ͻ�������ȷ����______![]() ����ĸ
����ĸ![]() ��
��
![]() ���ڴ�����
���ڴ�����![]() �ܶ�С��Ӳ�ȴ�
�ܶ�С��Ӳ�ȴ�![]() �ڿ������ױ���ʴ
�ڿ������ױ���ʴ
����·��������η�ֹ����ĸ�ʴ�ǹ��̼�����Ա���˵�����֮һ�����ڷ����绯ѧ��ʴʱ�ĸ�����Ӧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A.ʵ�����ô���ʯ��ϡ������ȡCO2��2H++CO32��= CO2��+H2O
B.������ˮ��Ӧ��Cl2+H2O = 2H++Cl��+ClO��
C.���������Ƽ����Ȼ����Һ��笠����ӣ�NH4++OH��![]() NH3��+H2O
NH3��+H2O
D.�Ȼ�����Һ���백ˮ��Al3++3OH��= Al��OH��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȼ�ϵ��ԭ�������Դ����Ա�ų��ķ�㣬ͬʱ�õ����ܡ����������Ƶķ����ǣ��������е�ѿ�߸˾������������������������������ֱ�ͨ��ȼ�ϵ���������������ɳ����������ʡ�ʾ��ͼ������ʾ������˵���������(����)
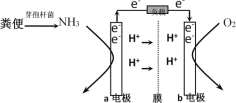
A.a�缫�Ǹ�����b�缫������
B.�����������ķ�Ӧ��2NH3 - 6e��=N2+6H+
C.��������ÿ���ı�״����2.24 L O2��a��b�缫ת��0.4 mol����
D.��ع���ʱ����ͨ����a����������b�缫���ٴ������ӽ���Ĥ�ص�a�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)25��ʱ��pH=5��CH3COOH��Һ�У���ˮ�������������Ũ��c(H+)=______
molL��1������Һ�м�������NaOH���壬����Һ��![]() _____(����������������С������������)��д����ʾ�û����Һ����������Ũ��֮���һ����ʽ��______��
_____(����������������С������������)��д����ʾ�û����Һ����������Ũ��֮���һ����ʽ��______��
(2)�״�(CH3OH)��һ�ֿ�������Դ�����й����Ŀ�����Ӧ��ǰ�����Լ״���������KOH��ҺΪԭ�ϣ�ʯīΪ�缫���������ֻ���أ��״���_____����Ӧ�����������������������缫��ӦʽΪ_____��
(3)��ĭ�������ԭ����________________________�������ӷ�Ӧ����ʽ��ʾ����
(4)Na2CO3��Һ���������ӵĴ�С��ϵ�ǣ�____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �ڹ�ҵ��ũҵ�ȷ����й㷺��Ӧ�ã���ҵ�Ͽ��ɸ������̿���Ҫ�ɷ�Ϊ
�ڹ�ҵ��ũҵ�ȷ����й㷺��Ӧ�ã���ҵ�Ͽ��ɸ������̿���Ҫ�ɷ�Ϊ![]() ������
������![]() ��
��![]() ��
��![]() ��
��![]() �����ʣ��Ʊ������ֹ���������ͼ��ʾ��
�����ʣ��Ʊ������ֹ���������ͼ��ʾ��

��ؽ������������������������![]() ����ʼ������
����ʼ������![]() ������Ũ��Ϊ
������Ũ��Ϊ![]() ���㣩��
���㣩��
�������� |
|
|
|
|
|
��ʼ������ | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
������ȫ�� | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
��1����������ʱ������Ӧ�����ӷ���ʽΪ______________��
��2������![]() ����Χ��5��6���õ�����2����Ҫ�ɷֳ�
����Χ��5��6���õ�����2����Ҫ�ɷֳ�![]() ���_____________��
���_____________��
��3�������ӡ������м���![]() ��Ŀ����______��
��Ŀ����______��
��4�������̡������з�����Ӧ�Ļ�ѧ����ʽΪ______��
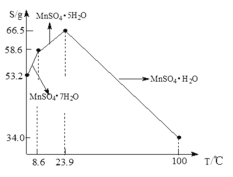
��5��![]() ��ˮ�е��ܽ�����¶ȹ�ϵ��ͼ����
��ˮ�е��ܽ�����¶ȹ�ϵ��ͼ����![]() ��ýϴ�����
��ýϴ�����![]() ����ķ����ǣ���
����ķ����ǣ���![]() ����������ϡ���ᣬ�����¶���
����������ϡ���ᣬ�����¶���![]() ֮�������ᾧ��______���õ�
֮�������ᾧ��______���õ�![]() ���壬ϴ�ӡ���ɡ�����ͨ�����ü�ѹ��ɵ�ԭ����______��
���壬ϴ�ӡ���ɡ�����ͨ�����ü�ѹ��ɵ�ԭ����______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com