
【题目】(1)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=______
molL﹣1;往溶液中加入少量NaOH固体,则溶液中![]() _____(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:______。
_____(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:______。
(2)甲醇(CH3OH)是一种可再生能源,具有广阔的开发和应用前景。以甲醇、氧气和KOH溶液为原料,石墨为电极制造新型手机电池,甲醇在_____极反应(填“正”或“负”),电极反应式为_____。
(3)泡沫灭火器的原理:________________________(用离子反应方程式表示)。
(4)Na2CO3溶液中所有离子的大小关系是:____________________。
【答案】10-9 mol/L 不变 c(CH3COO)+c(OH)=c(Na+)+c(H+) 负 ![]()
![]() c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
【解析】
(1)根据水的离子积公式计算醋酸溶液中氢氧根离子的浓度,再根据水电离出的氢氧根离子和氢离子浓度相等计算水电离出的氢离子浓度c(H+);
(2)燃料电池的反应原理相当于燃料的燃烧,通入燃料的电极为负极,通入氧气的电极为正极;
(4)根据碳酸钠在溶液中水解反应分析解答。
(1)pH=lgc(H+),则pH等于5的CH3COOH溶液中c(H+)=1.0×105mol/L,25℃时:Kw=c(OH)×c(H+)=1014,溶液中的![]() ,CH3COOH溶液中氢离子的来源为乙酸的电离和水的电离,但乙酸溶液中水电离出的氢离子浓度等于氢氧根离子浓度,所以由水电离出的c(H+)是1.0×109mol/L;往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中
,CH3COOH溶液中氢离子的来源为乙酸的电离和水的电离,但乙酸溶液中水电离出的氢离子浓度等于氢氧根离子浓度,所以由水电离出的c(H+)是1.0×109mol/L;往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中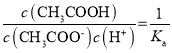 ,温度不变电离平衡常数不变,故该比值不变;溶液中存在电荷守恒,离子浓度关系为:c(CH3COO)+c(OH)=c(Na+)+c(H+),故答案为:10-9 mol/L;不变;c(CH3COO)+c(OH)=c(Na+)+c(H+);
,温度不变电离平衡常数不变,故该比值不变;溶液中存在电荷守恒,离子浓度关系为:c(CH3COO)+c(OH)=c(Na+)+c(H+),故答案为:10-9 mol/L;不变;c(CH3COO)+c(OH)=c(Na+)+c(H+);
(2)该电池为燃料电池,通入燃料甲醇的电极为负极,通入氧化剂氧气的电极为正极,负极上甲醇失电子和KOH反应生成碳酸钾和水,负极反应式为![]() ;故答案为:负;
;故答案为:负;![]() ;
;
(3)泡沫灭火器的原理为碳酸氢钠与硫酸铝相互促进水解生成二氧化碳和氢氧化铝,离子反应方程式可表示为:![]() ;
;
(4)碳酸钠为强碱弱酸盐,在溶液中只存在水解,CO32- +H2OHCO3- +OH-,HCO3-+H2OH2CO3+OH-,第一步的水解程度远远大于第二步的水解程度,另外溶液中还存在水的电离,水的电离是极微弱的,故Na2CO3溶液中所有离子的大小关系是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】对于H2(g)+I2(g)![]() 2HI(g),ΔH<0,根据如图,下列说法错误的是( )
2HI(g),ΔH<0,根据如图,下列说法错误的是( )
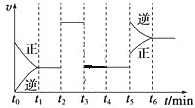
A.t2时可能使用了催化剂B.t3时可能采取减小反应体系压强的措施
C.t5时采取升温的措施D.反应在t6时刻,HI体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火电厂粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。某研究小组对其进行综合处理的流程如图所示:
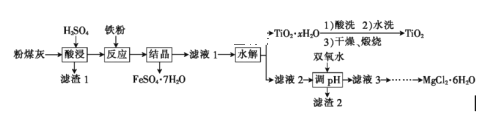
已知:①“酸浸”后钛主要以TiOSO4的形式存在,强电解质TiOSO4在溶液中仅能电离出SO42-和TiO2+,TiO2+在80℃左右水解生成TiO2·xH2O。
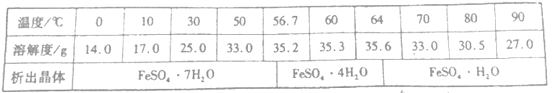
②已知FeSO4在不同温度下的溶解度和析出晶体的组成如下表:
回答下列问题:
(1)加快“酸浸”速率的措施有哪些?写出一条即可___,滤渣1的主要成分为___(填化学式)。
(2)“反应”时加入铁粉的作用为___(用离子方程式表示)。
(3)“结晶”时,若要获得FeSO4·7H2O,则对溶液进行的操作是:蒸发浓缩,___,过滤,洗涤,干燥。
(4)“水解”反应的离子方程式为____。
(5)实验室用MgCl2·6H2O制备MgCl2固体,在加热的同时要不断通入___(填化学式,下同)若不通入该物质,最终得到的产物中可能含有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)![]() 2NO(g) ΔH1=a kJ·mol-1
2NO(g) ΔH1=a kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH2=b kJ·mol-1
2NO2(g) ΔH2=b kJ·mol-1
③CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH3=c kJ·mol-1
CO2(g) ΔH3=c kJ·mol-1
④2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH4
N2(g)+2CO2(g) ΔH4
(1)根据反应①②③,确定反应④中ΔH4=___________ kJ·mol-1。
II. 如图是一个化学过程的示意图,请回答下列问题:
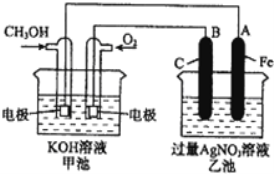
(2)请回答图中甲、乙两池的名称.乙池是_______________装置。
(3)通入甲醇的电极的电极反应式为_________________________________。
(4)乙池中反应的化学方程式为_____________________________________。
(5)电解一段时间后,乙池中A(Fe)极的质量增加5.4g时,且溶液的体积为500mL,求所得溶液在25℃时的pH=__________ ,甲池中消耗O2为 __________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 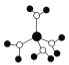 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. 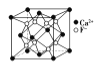 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C.  H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D.  金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)为用途极广的铬化合物,供制铬矾。火柴、铬颜料、并供鞣革、电镀、有机合成等用。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程如图所示:
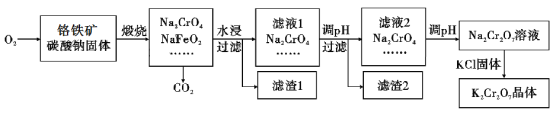
根据题意回答下列问题:
(1)锻烧时,铬铁矿发生复杂反应生成Na2CrO4和NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式是___。
(2)NaFeO2遇水强烈水解生成滤渣l的反应离子方程式是___。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7-8目的是___,滤液2调节pH约为5目的是___。
物质 | 溶解度/(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。此法能够制得K2Cr2O7晶体的原因是:___;为了从溶液中得到较多K2Cr2O7晶体的操作过程是:___、过滤、洗涤、干燥。将得到的K2Cr2O7晶体进一步纯化操作是:___。
(5)K2Cr2O7性质:往K2Cr2O7溶液中加入AgNO3溶液,生成一种砖红色沉淀、溶液的pH减小,反应离子方程式是___。
(6)K2Cr2O7产品含量测定:准确称取试样2.5g配成250mL溶液,用移液管吸取25.00mL溶液放入碘量瓶,加入10mL2mol/L硫酸、2gKI于暗处5min,另加100mL水,用0.2000mol/L Na2S2O3标准液滴定至溶液黄绿色,再加3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。平行三次实验,平均消耗Na2S2O3标准液的体积25.00mL。K2Cr2O7产品的纯度为___。
有关反应如下:K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+4K2SO4+3I2+7H2O
2Na2S2O3+I2=Na2S4O6+2NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量的叙述正确的是![]()
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.己知![]() 白磷,
白磷,![]() 红磷,
红磷,![]() ,则白磷比红磷稳定
,则白磷比红磷稳定
C.对于某一化学反应,当生成物中化学键形成时所吸收的能量大于反应物中化学键断裂所释放的能量时,该反应为吸热反应,![]()
D.若![]() ,
,![]()
![]() ,则含
,则含![]() gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于
gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于![]() kJ
kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A. 溶液的pH增大
B. CH3COOH电离度增大
C. 溶液的导电能力减弱
D. 溶液中c(OH-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com