
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是 ( )
A2(g)+B2(g)达到平衡状态的标志是 ( )
A.单位时间内生成n mol A2,同时消耗2n mol ABB.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率D.容器中各组分的浓度不随时间变化
【答案】D
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
A、单位时间内生成nmolA2的同时消耗2n molAB,都体现正向反应,不能说明反应达到平衡状态,故A错误;
B、可逆反应只要反应发生,就是反应物和生成物共存的体系,不能说明反应达到平衡状态,故B错误;
C、速率之比等于化学方程式计量数之比,AB的消耗速率等于A2的消耗速率的2倍说明反应达到平衡状态,但AB的消耗速率等于A2的消耗速率不能说明反应达到平衡状态,故C错误;
D、容器中各组分的浓度不随时间变化,说明达平衡状态,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 。下列关于该有机物分子结构的说法中正确的是
。下列关于该有机物分子结构的说法中正确的是
A. 最多有18个原子在同一平面内 B. 最多有4个碳原子在一条直线上
C. 最多有12个碳原子在同一平面内 D. 所有原子都可能在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2OH++OH-,在不同温度下其离子积为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14,则下列叙述中正确的是( )
A.c(H+)随温度的升高而降低
B.35℃时,c(H+)>c(OH-)
C.溶液pH:pH(35℃)>pH(25℃)
D.35℃时已电离的水的浓度约为1.45×10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,下列叙述正确的是![]()
A.![]() 的
的![]() 与
与![]() 混合溶液中
混合溶液中![]()
B.![]() 的可乐中
的可乐中![]() 是
是![]() 的柠檬水中
的柠檬水中![]() 的10倍
的10倍
C.AgCl在![]()
![]() 溶液和
溶液和![]() NaCl溶液中的溶解度相同
NaCl溶液中的溶解度相同
D.![]() 溶液加水稀释至100mL,pH和
溶液加水稀释至100mL,pH和![]() 均减小
均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知:lg2=0.3,Ksp(ZnS)=3×10-25 。下列有关说法正确的是( )

A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.该温度下Ksp(CuS)=4×10-36
D.向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如下图装置。下列叙述不正确的是
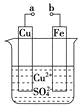
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C.a和b用导线连接时,电子由铜电极流向铁电极
D.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.强碱性溶液中NaClO将Fe(OH)3氧化为FeO42-:3ClO+2Fe(OH)3=2FeO42-+3Cl+4H++H2O
B.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
C.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:S2O32-+2H+=SO2↑+S↓+H2O
D.向NH4HCO3溶液中加入足量石灰水:Ca2++HCO3-+OH=CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com