
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 实验事实 | 结 论 | |
| A | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| B | HCl与Na2CO3溶液反应生成CO2 | 可用饱和Na2CO3溶液除去CO2中的少量HCl |
| C | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| D | SO2通入KMnO4酸性溶液中,红色褪去 | SO2有漂白性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X |
| X |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
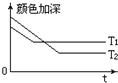 (1)反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,温度(T)之间的关系如图所示(B、C均为无色物质):
(1)反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,温度(T)之间的关系如图所示(B、C均为无色物质):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管1中, | 样品全部溶解,得到澄清的溶液. |
| 步骤2. 步骤3. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C、在0℃、1.01KPa下,22.4L的NO气体与11.2L的O2混合,气体分子数为NA |
| D、在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com