


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )| A、原子半径:X<Z<W |
| B、非金属性:Y>Z |
| C、最高化合价:X<Y |
| D、最高价氧化物对应水化物的酸性:W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
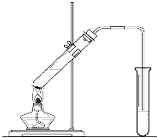 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
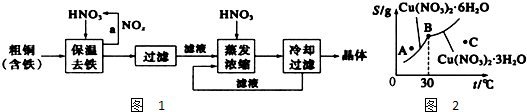
查看答案和解析>>
科目:高中化学 来源: 题型:
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
(1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 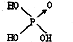 | 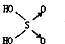 | 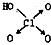 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、S2-、Cl- |
| B、Al3+、HCO3-、SO42-、Cl- |
| C、K+、Na+、SiO32-、NO3- |
| D、K+、Cl-、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com