
 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
| ||
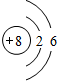 ,故答案为:
,故答案为: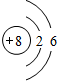 ;
;| 1mol |
| 3 |


科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaX | NaF | NaCl | NaBr | NaI |
| 熔点 | 995 | 801 | 775 | 651 |
| SiX4 | SiF4 | SiCl4 | SiBr4 | SiI4 |
| 熔点 | -90.2 | -70.4 | 5.2 | 120.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.| 放电 |
| 充电 |
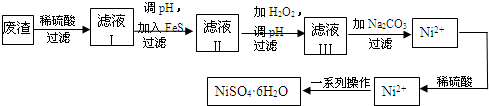
查看答案和解析>>
科目:高中化学 来源: 题型:
 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B元素组成的一种单质具有漂白性,能使KMnO4溶液紫色褪去 |
| B、B、D两种元素形成的一种化合物也具有一定的漂白性,能使紫色石蕊紫色褪去 |
| C、C元素分别与A元素和B元素形成的化合物都是离子晶体,一定均与水反应生成强碱和无色气体 |
| D、A2B的热稳定性强于A2D、沸点也高于A2D,但解释的理由不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com