

| 充电 |
| 放电 |
| 6.40g |
| 64g/mol |


科目:高中化学 来源: 题型:
 科学研究表明,月球上可能存在少量水:月岩中含有钛铁矿,其主要成分的晶胞如图所示.
科学研究表明,月球上可能存在少量水:月岩中含有钛铁矿,其主要成分的晶胞如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
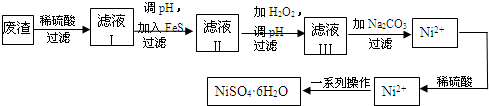
 铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 加入试剂 | 操作方法 |
| ①粗苯甲酸的提纯 | ||
| ②乙醇(水) | ||
| ③乙酸乙酯(乙酸) | ||
| ④乙烷(乙烯) | ||
| ⑤苯(酒精) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不需要通过化学反应就能从海水中获得食盐和淡水 |
| B、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| C、高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害 |
| D、氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa2O2中含4NA个离子 |
| B、常温常压下,46gNO2和N2O4混合物含有原子数为3NA |
| C、标准状况下,22.4LCHCl3中含有的氯原子数为3NA |
| D、18gD2O中含有的质子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com