
 科学研究表明,月球上可能存在少量水:月岩中含有钛铁矿,其主要成分的晶胞如图所示.
科学研究表明,月球上可能存在少量水:月岩中含有钛铁矿,其主要成分的晶胞如图所示.| 6+3-1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 8 |
| 6+3-1 |
| 2 |


科目:高中化学 来源: 题型:

| A、Ⅰ和Ⅱ中正极均被保护 |
| B、Ⅰ和Ⅱ中负极反应均是:Fe-2e-═Fe2+ |
| C、Ⅰ正极反应是:O2+2H2O+4e-═4OH- |
| D、Ⅰ和Ⅱ中分别加入少量KSCN溶液,溶液均变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )| A、原子半径:X<Z<W |
| B、非金属性:Y>Z |
| C、最高化合价:X<Y |
| D、最高价氧化物对应水化物的酸性:W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 物质 | 起始浓度/(mol?L-1 | 平衡浓度/(mol?L-1 |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A、平衡后,分别压缩容器Ⅰ、Ⅱ,则Ⅰ、Ⅱ中气体颜色都将变深 |
| B、平衡时,Ⅰ、Ⅱ中反应物的转化率a(N2O4)<a(NO2) |
| C、平衡时,Ⅰ、Ⅱ中反应的平衡常数K(Ⅰ)═2K(Ⅱ) |
| D、平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
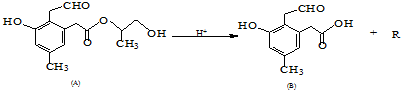
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.
元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.查看答案和解析>>
科目:高中化学 来源: 题型:
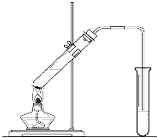 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
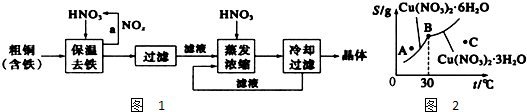
查看答案和解析>>
科目:高中化学 来源: 题型:

| 充电 |
| 放电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com