
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
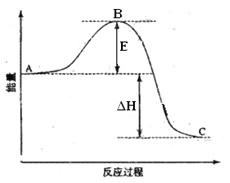
(1)图中A、C分别表示 、 ,
E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1
,则υ(O2)= mol·L-1·min-1、
υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,求由S(s)生成3 molSO3(g)的△H= 。
【答案】(1)没有影响 降低
(2)-198 (3)SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5 (4)0.025 0.05
(5)-1 185 kJ/mol
【解析】
(1)由图像可知E代表活化能,和反应热无关。催化剂能降低反应的活化能,从而加快反应速率。
(2)1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol,而方程式中二氧化硫是2mol,所以ΔH=-198 kJ/mol.
(3)根据所给元素化合价的变化可写出反应的方程式,SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5 。
(4)因为化学反应速率之比是相应的化学计量数之比,所以v(O2)=0.025mol/(L·min)、v(SO3)=0.05mol/(L·min).
(5)考查盖斯定律的应用。由反应① 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g)
2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g)![]() SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g)
SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g)![]() 2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=
2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=![]() 。
。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:
阳离子 | K+、NH4+、Mg2+、Ba2+、 Fe3+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):

(1)由气体B可确定待测液中含有的离子是______________。
(2)由沉淀D和沉淀E可以判断待测液中一定含有______离子,据此可以排除的离子是________。
(3)由白色沉淀B可确定待测液中含有的离子是__________________。
(4)某同学读图后,认为待测液一定不含溴离子,他判断的依据是_________________。
(5)综合分析,待测液中K+的最小浓度为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,不属于氮的固定的是( )
A. 闪电时,N2变为NO B. NO被空气中O2氧化为NO2
C. 工业上,用N2合成氨 D. 豆科植物根瘤菌把N2变成NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO和H2的混合气体称为水煤气,可由碳与水蒸气在高温下反应生成。如下图:

已知:单质E可作为半导体材料,化合物F是有毒的氧化物,C常温下为液态。据此,请填空:(用化学式回答)
(1)氧化物A是_____________
(2)化合物F是___________
(3)反应②的化学方程式是_____________________________________
(4)反应③的化学方程式是_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)![]() 2C(g) ΔH<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是
2C(g) ΔH<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是

A. 反应开始2 min内,v(B)=0.1 mol/(L·min)
B. t1时改变的条件可能是升高温度
C. t3时改变的条件可能是加压,此时c(B)不变
D. t4时可能是使用了催化剂,此时c(B)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金用途广泛,如新型储氢合金材料的研究和开发,将为氢气作为能源的实际应用起到重要的推动作用。下列材料中,不属于合金的是
A. 青铜 B. 黄铜
C. 陶瓷 D. 不锈钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
A. ②③⑤ B. ①④⑦ C. ②⑦⑨ D. ⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖是人类的营养素,在体内富氧条件下被氧化生成二氧化碳和水,在缺氧条件下则生成一种有机酸A。已知:
①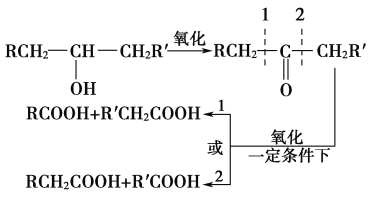
②将A进行如图所示的反应,其中C和C′是同系物,C′是甲酸(HCOOH)。
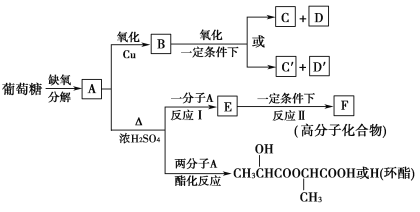
回答下列问题:
(1)C和D′属于________(填序号)。
①同系物 ②同分异构体 ③同类物质 ④同素异形体
(2)D′和E分别属于哪一类化合物:D′____________,E____________(填序号)。
①多元醇 ②醛 ③不饱和羧酸 ④多元羧酸 ⑤酯
(3)写出结构简式:A________,F________,H________。
(4)写出反应类型:反应Ⅰ:____________________,反应Ⅱ:____________________。
(5)写出下列转化的化学方程式:
A→B__________________________________________________________;
A→E__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com