
【题目】一种浓差电池如图所示,阴、阳离子交换膜交替放置,中间的间隔交替充以河水和海水,选择性透过Cl和Na+,在两电极板形成电势差,进而在外部产生电流。下列关于该电池的说法正确的是( )
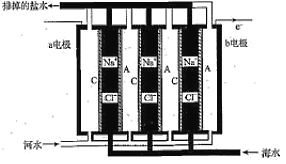
A.a电极为电池的正极,电极反应为2H++2e═H2↑
B.C为阴离子交换膜,A为阳离子交换膜
C.负极隔室的电中性溶液通过阳极表面的还原作用维持
D.该电池的缺点是离子交换膜价格昂贵,优点是电极产物有经济价值
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】铝在酸性或碱性溶液中均可与NO3—发生氧化还原反应,转化关系如下图所示:
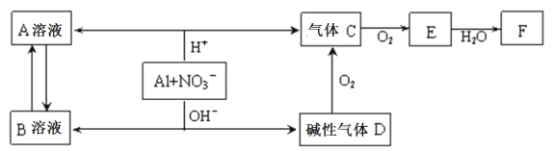
下列说法错误的是
A.B溶液含[Al(OH)4]—
B.A溶液和B溶液混合无明显现象
C.D与F反应生成盐
D.E排入大气中会造成污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B的结构简式如下
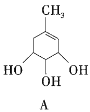
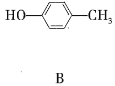
(1)A分子中含有的官能团的名称是__________;B分子中含有的官能团的名称是___________。
(2)A能否与氢氧化钠溶液反应?__________(填“能”或“不能”,下同);B能否与氢氧化钠溶液反应?________。
(3)A在浓硫酸作用下加热可得到B,其反应类型是________________。
(4)A、B各1mol分别加入足量浓溴水,完全反应后消耗单质溴的物质的量分别是______ mol、______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下 0.1mol/L的H2A溶液中H2A、HA-、A2-在三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。回答下列问题:
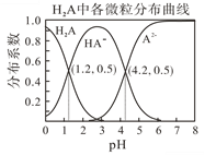
(1)H2A的电离方程式是__________________,二级电离常数K2=_________。
(2)已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.相对分子质量为72的某烷烃,一氯代物有4种
B.四苯基乙烯![]() 中所有碳原子一定处于同一平面
中所有碳原子一定处于同一平面
C.在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应
D.![]() 和
和![]() 分子组成相差一个“-CH2-”,因此是同系物
分子组成相差一个“-CH2-”,因此是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种有机物A的质谱图和红外光谱图如图,以下说法正确的是( )
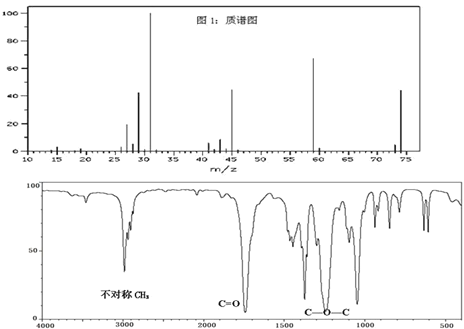
A.由质谱图可知,有机物A的摩尔质量为74
B.由红外光谱可知,有机物A的分子式C3H6O2
C.有机物A的核磁共振氢谱图中有3种吸收峰,峰面积之比为1:2:3
D.有机物A的名称为甲酸乙酯,官能团为酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素是一种金属化学元素,也是人体所必须的一种微量元素, 铜也是人类最早发现的金属,是人类广泛使用的一种金属,属于重金属。
(1)写出基态铜原子的价层电子排布式_________________。
(2)简单金属离子在水溶液中的颜色大多与价层电子中含有的未成对电子数有关,如Fe3+呈黄色,Fe2+呈绿色,Cu2+呈蓝色等。预测Cu+为_____色,解释原因________________。
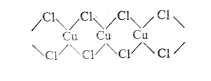
(3)X射线研究证明,CuCl2的结构为链状,如图所示,它含有的化学键类型为_________,在它的水溶液中加入过量氨水,得到 [Cu(NH3)4]Cl2溶液, [Cu(NH3)4]Cl2中H-N-H的夹角_________(填“大于”、“等于”或“小于”)NH3分子中的H-N-H的夹角,原因是___________。
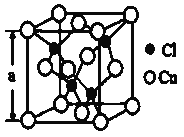
(4)某种铜的氯化物晶体结构如图:此晶体中铜原子的配位数是__________,若氯原子位于铜形成的四面体的体心,且铜原子与铜原子、铜原子与氯原子都是采取最密堆积方式,则氯原子与铜原子半径之比为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期元素,原子序数依次增大,A、D同主族,A2—和B+具有相同的电子层结构;C、E为同周期元素,C核外电子总数是最外层电子数的3倍;E元素最外层有一个未成对电子;F的最外层只有1个电子,但次外层有18个电子。
请回答下列问题:
(1)基态F原子的核外电子排布式为______,F元素在周期表中的位置______,F2+能与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为______。
(2)六种元素中电负性最小的是______,其中C、D、E的第一电离能由大到小的顺序为______(填元素符号)。
(3)A、D的简单氢化物中沸点较高的物质是______(填化学式),原因是______。
(4)C和E的单质反应可生成组成比为1:3的化合物,该化合物的立体构型名称为 ______,中心原子的杂化轨道类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸(化学式HCOOH,分子式CH2O2,相对分子质量46),俗名蚁酸,是最简单的羧酸,无色而有刺激性气味的易挥发液体。熔点为8.6 ℃,沸点100.8℃,25℃电离常数Ka=1.8×10-4。某化学兴趣小组进行以下实验。
Ⅰ.用甲酸和浓硫酸制取一氧化碳
A. 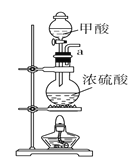 B.
B. 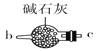 C.
C. 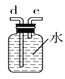 D.
D. 
(1)请说出图B中盛装碱石灰的仪器名称__________。用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,反应的化学方程式是________;实验时,不需加热也能产生CO,其原因是_______。
(2)如需收集CO气体,连接上图中的装置,其连接顺序为:a→__________(按气流方向,用小写字母表示)。
Ⅱ.对一氧化碳的化学性质进行探究
资料:ⅰ.常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,可用于检验CO;
ⅱ.一定条件下,CO能与NaOH固体发生反应:CO+NaOH![]() HCOONa
HCOONa
利用下列装置进行实验,验证CO具有上述两个性质。
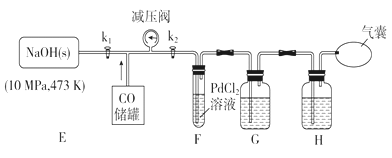
(3)打开k2,F装置中发生反应的化学方程式为_____________;为了使气囊收集到纯净的CO,以便循环使用,G装置中盛放的试剂可能是_________,H装置的作用是____________。
(4)现需验证E装置中CO与NaOH固体发生了反应,某同学设计下列验证方案:取少许固体产物,配置成溶液,在常温下测该溶液的pH,若pH>7,证明CO与NaOH固体发生了反应。该方案是否可行,请简述你的观点和理由:________,_________。
(5)25℃甲酸钠(HCOONa)的水解平衡常数Kh的数量级为____________。若向100ml 0.1mol.L-1的HCOONa溶液中加入100mL0.2mol.L-1的HCl溶液,则混合后溶液中所有离子浓度由大到小排序为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com