
【题目】A、B、C、D、E、F为前四周期元素,原子序数依次增大,A、D同主族,A2—和B+具有相同的电子层结构;C、E为同周期元素,C核外电子总数是最外层电子数的3倍;E元素最外层有一个未成对电子;F的最外层只有1个电子,但次外层有18个电子。
请回答下列问题:
(1)基态F原子的核外电子排布式为______,F元素在周期表中的位置______,F2+能与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为______。
(2)六种元素中电负性最小的是______,其中C、D、E的第一电离能由大到小的顺序为______(填元素符号)。
(3)A、D的简单氢化物中沸点较高的物质是______(填化学式),原因是______。
(4)C和E的单质反应可生成组成比为1:3的化合物,该化合物的立体构型名称为 ______,中心原子的杂化轨道类型为______。
【答案】1s22s22p63s23p63d104s1(或[Ar]3d104s1) 第四周期ⅠB族 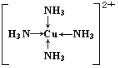 Na Cl>P>S H2O 水分子间能形成氢键 三角锥形 sp3
Na Cl>P>S H2O 水分子间能形成氢键 三角锥形 sp3
【解析】
A、B、C、D、E、F为前四周期元素,原子序数依次增大,A、D同主族,A2-和B+具有相同的电子层结构,则A位于第二周期ⅥA族,为O元素,B为Na,D为S;C、E为同周期元素,C核外电子总数是最外层电子数的3倍,其原子序数小于S大于Na,则C、E位于第三周期,E的原子序数大于S,且E元素最外层有一个未成对电子,则E为Cl元素;设C最外层电子数为x,3x=2+8+x,解得x=5,则C为P;F的最外层只有1个电子,但次外层有18个电子,其核外电子排布式为[Ar]3d104s1,则F为Cu元素,据此分析解答。
根据分析可知,A为O,B为Na,C为P,D为S,E为Cl,F为Cu元素。
(1)F为Cu,其原子序数为29,电子排布为1s22s22p63s23p33d104s1(或[Ar]3d104s1),则F位于周期表中第四周期ⅠB族;Cu2+与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为 ,故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);第四周期ⅠB族;
,故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);第四周期ⅠB族; ;
;
(2)上述元素中Na的金属性最强,则电负性最小的是Na;同周期从左到右第一电离能呈增大趋势,但P元素3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Cl>P>S,故答案为:Na;Cl>P>S;
(3)水分子间存在氢键,导致其沸点较高,而硫化氢分子间不能形成氢键,其沸点比水的低,故答案为:H2O;水分子间能形成氢键;
(4)C和E的单质反应可生成组成比为1∶3的化合物,该化合物为PCl3,PCl3分子中P形成3个δ键,孤电子对数为:![]() =1,则P采用sp3杂化,立体构型为三角锥形,故答案为:三角锥形;sp3。
=1,则P采用sp3杂化,立体构型为三角锥形,故答案为:三角锥形;sp3。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、________________、________。
(2)写出Na2SO3固体氧化变质的化学方程式_____________。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是__________________________,
在过滤前,需要检验是否沉淀完全,其操作是______________。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果________(填“偏高”或“偏低”)。
(5)若操作正确,则m1________m2(填“>”、“<”或“=”),原因是_______________。
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为_____________(注明表达式中所用的有关符号的含义和单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物X、Y、Z的名称和结构简式如下表,下列说法不正确的是
X | Y | Z | |
名称 | 3-甲氧基-4-羟基扁桃酸 | 没食子酸乙酯 | 丁香酸 |
结构简式 |
|
|
|
A.X、Y、Z都能与NaOH溶液反应
B.X、Y互为同分异构体,X、Z互为同系物
C.依据X的名称,可推测出Z的名称为3,5-二甲氧基-4-羟基苯甲酸
D.推测出没食子酸的分子式为C7H6O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.pH=1的溶液中:HCO3﹣、NH4+、NO3﹣、Ca2+
B.在强碱性溶液中:Na+、K+、AlO 2﹣、Cl﹣
C.无色溶液中:Fe3+、MnO4﹣、Cl﹣、H+
D.由水电离的c(H+)=1.0×10﹣12 molL﹣1的溶液中:ClO﹣、Na+、![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是
A. 该酸式盐的水溶液一定显酸性
B. 在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 若HY-能水解,水解方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
D. 若HY-能电离,电离方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20mL浓度均为0.1mol/L的NaOH和MOH溶液中分别滴加0. 1mol/L盐酸,溶液的pH随盐酸体积变化如图所示。下列说法不正确的是( )
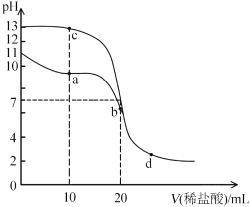
A.MOH的电离常数约为1×l0-5B.a点溶液中存在![]()
C.b点和c点溶液混合后显碱性D.水的电离程度:d>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com