
【题目】有下列七种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④CH3COONa ⑤CH3COOH ⑥NaHCO3
(1)溶液呈酸性的有_____________,呈碱性的有____________
(2)分别写出②、④水解的离子方程式:_____________________________、_____________________________。
(3)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类_____________(填“相同”或“不相同”),溶液的PH:③_________⑥(填 >、=或 <)。
【答案】②⑤ ③④⑥ NH4++H2O![]() NH3·H2O+H+ CH3COO-+H2O
NH3·H2O+H+ CH3COO-+H2O![]() CH3COOH+OH- 相同 >
CH3COOH+OH- 相同 >
【解析】
酸和强酸弱碱盐溶液显酸性,碱和强碱弱酸盐溶液显碱性。强酸强碱盐溶液显中性。
(1)所给物质中⑤为酸,②为强酸弱碱盐,都显酸性。③④⑥为强碱弱酸盐,都显碱性。
(2)氯化铵溶液中铵根离子水解生成一水合氨和氢离子,溶液显酸性,水解方程式为NH4++H2O![]() NH3·H2O+H+;醋酸钠中的醋酸根离子水解生成醋酸和氢氧根离子,水解方程式为:CH3COO-+H2O
NH3·H2O+H+;醋酸钠中的醋酸根离子水解生成醋酸和氢氧根离子,水解方程式为:CH3COO-+H2O![]() CH3COOH+OH-;
CH3COOH+OH-;
(3).碳酸钠和碳酸氢钠中含有的离子为Na+、HCO3-、CO32-、H+、OH-,离子种类相同,但等浓度时,碳酸根离子水解程度大于碳酸氢根离子的水解程度,故前者碱性强。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为__________(填字母序号)。
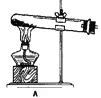

![]()

(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B中发生反应的离子方程式____________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快” __________(选填“能”或“不能”);简述你的理由:_______________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有(___________)(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
p>①所用指示剂为__________;滴定终点时的现象为_____________________________________;②H2C2O4溶液物质的量浓度为__________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216.4 kJ·mol-1
CO(g)+3H2(g) ΔH1=+216.4 kJ·mol-1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH=_________________________。
CO2(g)+4H2(g) ΔH=_________________________。
(2)起始时投入氮气和氢气的物质的量分别为1 mol、3 mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是________(填序号)。
A N2和H2的转化率相等 B 反应体系密度保持不变
C c(H2)/c(NH3 )保持不变 D c(NH3 )/c(N2)=2
②p1________(填“>”、“<”、“=”或“不确定”,下同)p2;反应的平衡常数:B点________D点。
③C点H2的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氨气的平均速率:v(A)________v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式________________________________。
②已知25 ℃时,N2H4的水溶液呈弱碱性:N2H4+H2O![]() N2H5++OH-K1=1×10-a N2H5++H2O
N2H5++OH-K1=1×10-a N2H5++H2O![]() N2H62++OH- K2=1×10-b25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH的范围为__________________________________(用含a、b的式子表示)。
N2H62++OH- K2=1×10-b25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH的范围为__________________________________(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应 aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的物质的量变多 D. a>c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
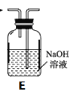
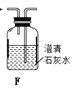
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):

请回答下列问题:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是________(填标号)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是________。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是___________________。
在分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.⑴指出如下图实验装置中的错误之处(加热装置中烧杯底部已垫有石棉网)
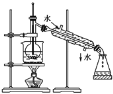
①____________________;
②____________________。
⑵图是某学生的过滤操作示意图,其操作不规范的是______

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
Ⅱ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:


⑴指出提取碘的过程中有关实验操作①和②的名称:__________;________。
⑵在3 mL含碘的水溶液中加入1mL四氯化碳,振荡静置后观察到试管里的分层现象是上图中的_____(注:试管中深色区为有色溶液),上层无色溶液的溶质是_____下层颜色是_____。
⑶从含碘的有机溶液中提取碘和回收有机溶剂,还需经过的操作是_______。
Ⅲ.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

欲证明滤液中存在SO42-、OH-,选用的方案是先取少量的滤液滴加________,发现溶液变红,再向其中加入________溶液,出现白色沉淀,则可证明SO42-、OH-,均存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为_______________________。
(2)EAB2D4水溶液显酸性的原因是____________________________________。
(3)将等浓度等体积的EBC溶液和ABC溶液混合,所得混合溶液(呈碱性)中各微粒(水分子除外)浓度由大到小的顺序为_________________________________________。
(4)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2溶液反应的离子方程式__________________________________。
(5)常温下,测得X和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是_________。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2(g)![]() 2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5 mol、A2:0.2 mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18 molC2,平衡将______移动(填“正向”、“逆向”或“不”)。
2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5 mol、A2:0.2 mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18 molC2,平衡将______移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com