
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )
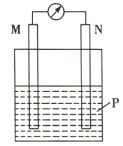
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 锌 | 稀硫酸 |
C | 银 | 锌 | AgNO3溶液 |
D | 铜 | 铁 |
|
A.AB.BC.CD.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.烷烃中除甲烷外,很多都能使酸性![]() 溶液的紫色退去
溶液的紫色退去
B.甲烷跟氯气反应无论生成![]() 、
、![]() 、
、![]() 还是
还是![]() ,都属于取代反应
,都属于取代反应
C.分子式符合![]() 的烃一定是烷烃
的烃一定是烷烃
D.甲烷能够燃烧,在一定条件下会发生爆炸,因此甲烷是矿井安全的重要威胁之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验设计能达到实验目的的是( )
选项 | 实验目的 | 实验设计 |
A | 证明非金属性强弱:Cl>C>Si |
|
B | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
C | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
D | 证明相同温度下: Ksp(Ag2S)<Ksp(AgCl) | 向2 mL 0.1 mol·L-1硝酸银溶液中加入1 mL 0.1 mol·L-1 NaCl溶液,出现白色沉淀,再加入 几滴0.1 mol·L-1 Na2S溶液,有黑色沉淀生成 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根皮素J(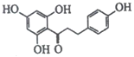 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
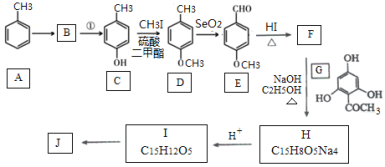
已知:
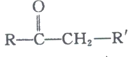 +R’’CHO
+R’’CHO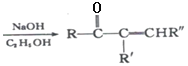 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向Al2O3和过量C粉的混合物中通入氯气,可制得易水解的AlCl3,实验装置如图所示。下列说法不正确的是
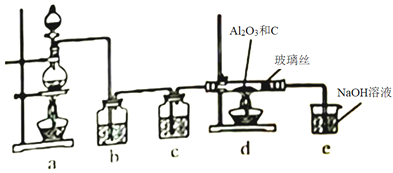
A. c中盛装的是浓硫酸
B. 实验时应先点燃d处酒精灯,再点燃a处酒精灯
C. 此反应中的尾气,除氯气外都可直接排放到大气中
D. 该装置不完善,其中应改进的一项是在d、e之间添加一个干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
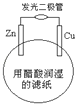
A. 铜片上的电极反应:Cu — 2e﹣ = Cu2+
B. 锌片为电池的负极
C. 外电路中电子由铜片经导线流向锌片
D. 电池工作时电能直接转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理汽车尾气和燃煤尾气是环境保护的重要课题.请回答下列问题:
(1)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
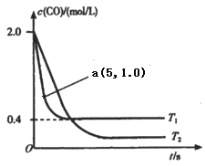
①据此判断该反应的正反应为____(填“放热”或“吸热”)反应.
②温度T1时,该反应的平衡常数K=_____;反应速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处v(正):v(逆)=________.
(2)下图流程是一种新型的除去尾气中氮氧化物的技术,一般采用氨气或尿素作还原剂
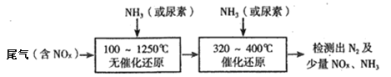
该技术中用尿素[CO(NH2)2]作还原剂还原NO2的主要反应为:4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
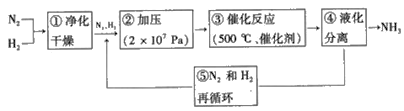
(3)哈伯法合成氨的流程图如图,下列五个流程中为提高原料利用率而采取的措施________(填序号)
(4)一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+.下列叙述正确的是______________(填选项)
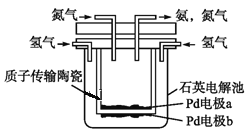
A.Pd电极b为阴极 B.阴极的反应式为N2+6H++6e-=2NH3
C.H+由阳极向阴极迁移 D.陶瓷可以隔离N2和H2
(5)也可用CH4催化还原NOx法消除烟气中氮氧化物的污染.已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Na2SO3、Na2S04混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A. 将样品配制成溶液V1L,取其中25.00 mL用标准KMn04溶液滴定,消耗标准 KMn04 溶液V2 mL
B. 向样品中加足量H202,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C. 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g
D. 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHS03的洗气瓶、盛有浓H2S04的洗气瓶、盛有碱石灰的干燥管I、盛有碱石灰的干燥管II,测得干燥管I增重dg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,![]() 无水乙醇所含碳氢键数目为
无水乙醇所含碳氢键数目为![]()
B.足量![]() 与含
与含![]() 的浓盐酸完全反应,转移电子数为
的浓盐酸完全反应,转移电子数为![]()
C.标准状况下,![]() 氦气和氖气的混合气体中原子数为
氦气和氖气的混合气体中原子数为![]()
D.含![]() 和
和![]() 共
共![]() 的
的![]() 溶液中含有的
溶液中含有的![]() 数目为
数目为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com