
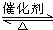 N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度(任写一种).
N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度(任写一种).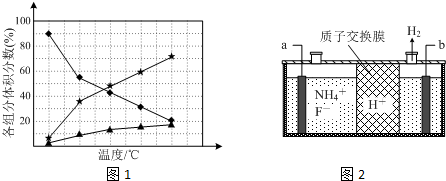
分析 (1)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
由盖斯定律可知(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l);
(2)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,依据氧化还原反应得失电子守恒回答即可;
②使湿润的红色石蕊试纸变蓝的气体为氨气,由图1得知:温度越高,肼的百分含量越低,即分解的越快;
(3)①电解含NH4F等的无水熔融物生产NF3,N元素被氧化,则a为阳极;
②NF3与Si3N4发生氧化还原反应,生成氮气和四氟化硅,无残留;
③NF3分子中N为+3价,有较强氧化性,易发生氧化还原反应;
④NF3与水反应生成硝酸和HF酸,方程式为3NF3+5H2O=2NO↑+9HF+HNO3.
解答 解:(1)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l),故△H4=-906.5-(229.3×5)-(44×6)=-2317kJ•mol-1,
故答案为:-2317;
(2)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O,
故答案为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O;
②使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N2H4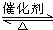 N2+4NH3,由图1可知,温度越高,肼的体积分数含量越低,故要抑制肼的分解,应降低反应温度,故答案为:3N2H4
N2+4NH3,由图1可知,温度越高,肼的体积分数含量越低,故要抑制肼的分解,应降低反应温度,故答案为:3N2H4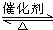 N2+4NH3;降低反应温度;
N2+4NH3;降低反应温度;
(3)①电解含NH4F等的无水熔融物生产NF3,N元素被氧化,则a为阳极,发生NH4++3F--6e-=NF3+4H+,
故答案为:阳;NH4++3F--6e-=NF3+4H+;
②NF3与Si3N4发生氧化还原反应,反应方程式为4NF3+Si3N4=4N2↑+3SiF4↑,生成氮气和四氟化硅,无残留,故答案为:4NF3+Si3N4=4N2↑+3SiF4↑;
③NF3分子中N为+3价,有较强氧化性,易发生氧化还原反应,故答案为:NF3分子中N为+3价,有较强氧化性,
④NF3与水反应生成硝酸和HF酸,方程式为3NF3+5H2O=2NO↑+9HF+HNO3,故答案为:3NF3+5H2O=2NO↑+9HF+HNO3.
点评 本题考查较为综合,涉及盖斯定律的应用、氧化还原反应方程式书写、电解池反应原理等知识,为高频考点,侧重于学生的分析、计算能力的考查,综合性较强,难度较大,注意相关知识的整理归纳.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
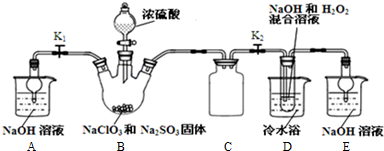
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是碱性氧化物 | |
| B. | Na2O2中阴阳离子个数比为1:1 | |
| C. | 可用澄清石灰水来区分Na2CO3 和NaHCO3 | |
| D. | 与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
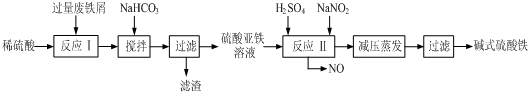
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
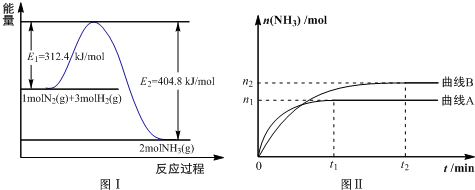
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.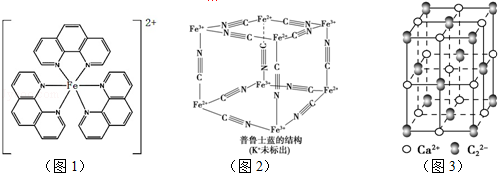
 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )| A. | A点时c(CH3COO-)>c(Na+) | |
| B. | 室温时0.01mol.L-1的醋酸溶液pH=6 | |
| C. | OA段溶液中均有:c(CH3COO-)>c(CH3COOH) | |
| D. | 若B点时加入NaOH溶液40mL,所得溶液中:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com