
【题目】下列不能说明氯元素的非金属性比硫元素强的是( )
①![]() 比
比![]() 稳定
稳定
②![]() 氧化性比
氧化性比![]() 强
强
③![]() 酸性比
酸性比![]() 强
强
④![]() 能与
能与![]() 反应生成S
反应生成S
⑤![]() 与
与![]() 反应生成
反应生成![]() ,S与
,S与![]() 反应生成
反应生成![]()
A.①⑤B.②C.①④D.①③⑤
【答案】B
【解析】
①元素的非金属性越强,对应的氢化物越稳定。因为HCl比 H2S稳定,所以Cl比S非金属性强,故①正确;
②根据最高价氧化物的水化物的含氧酸的酸性强弱来比较非金属性的强弱,最高价含氧酸的酸性越强,则元素的非金属性越强,HClO不是最高价含氧酸,故②错误;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,因为HClO4酸性比![]() 强,所以Cl比S非金属性强,故③正确;
强,所以Cl比S非金属性强,故③正确;
④元素的非金属性越强,对应的单质的氧化性越强,因为Cl2能与H2S反应生成S,所以Cl比S非金属性强, 故④正确;
⑤元素的非金属性越强,对应的单质的氧化性越强,与变价金属反应的氧化化合价越高,Cl2与 Fe反应生成FeCl3,S与Fe反应生成FeS,说明Cl2 的氧化性大于S,所以非金属性Cl大于S,故⑤正确;
故选 B。


科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂DCHP可由环己醇制得。DCHP和环己醇的结构简式如图所示,下列说法错误的是( )
![]()
环己醇
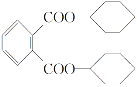
DCHP
A. DCHP的分子式为C20H26O4
B. 环己醇分子中所有碳原子不可能共平面
C. DCHP的一氯取代物有5种
D. DCHP通过取代反应可以得到环己醇
查看答案和解析>>
科目:高中化学 来源: 题型:
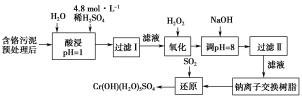
【题目】某工厂对工业污泥中的铬元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表所示:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7 | — | — | — |
沉淀完全时的pH | 3.2 | 9 | 11.1 | 8 | 9(>9溶解) |
(1)实验室用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是__________。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是__________。(用离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是________。
(5)钠离子交换树脂的原理为Mn++nNaR![]() MRn+nNa+,被交换的杂质离子是________。
MRn+nNa+,被交换的杂质离子是________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____Na2Cr2O7+____SO2+___ ___=___Cr(OH)(H2O)5SO4+___Na2SO4。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下信息书写反应方程式:
(1)Co3O4被认为在替代贵金属基催化剂中具有良好前景,利用钴渣[含Co(OH)3、Fe(OH)3等]制备CoC2O4的工艺流程如下:
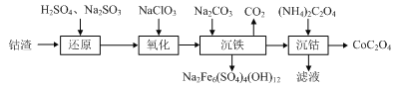
①写出“还原”中Co(OH)3反应的离子方程式: _______ 。
②写出“氧化”(ClO![]() 被还原为Cl-)中Fe2+反应的离子方程式: _______ 。
被还原为Cl-)中Fe2+反应的离子方程式: _______ 。
③写出“沉铁”反应的离子方程式: _______ 。
④NaClO3可以由惰性电极电解食盐水得到,写出该反应的化学方程式: _______ 。
(2)一种NH3催化还原NO的物质转化如图所示。若参与反应的NH3和O2的物质的量之比为4∶1,写出转化时总反应的化学方程式: _______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.将纯水加热后,水的电离程度增大,pH不变
B.反应2H2(g)+O2(g)=2H2O(l)在一定条件能自发进行的原因是ΔS<0
C.常温下,向0.1 mol·L-1 NH4Cl溶液中通入少量HCl,溶液中![]() 增大
增大
D.常温下,向CaCO3悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4![]() 6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
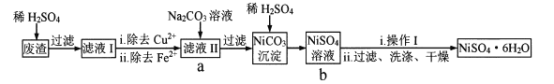
A. 溶解废渣时不能用稀盐酸代替稀H2SO4B. 除去Cu2+可采用FeS
C. 流程中a-b的目的是富集NiSO4D. “操作I”为蒸发浓缩、冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用下图所示电解装置吸收和转化SO2(A、B均为惰性电极)。下列说法正确的是
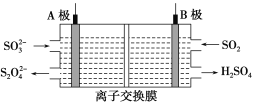
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e-+2H2O ===![]() +4H+
+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为__。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的__区。
(3)实验室常用KSCN溶液、苯酚(![]() )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为__(用元素符号表示),苯酚中碳原子的杂化轨道类型为__。
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为__(用元素符号表示),苯酚中碳原子的杂化轨道类型为__。
(4)铁元素能与CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__molσ键,与CO互为等电子体的一种离子的化学式为__。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的__空隙和__空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为__。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为__。
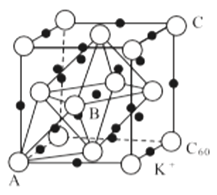
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为__,晶胞参数为428pm,则晶体密度为__g/cm3(NA表示阿伏伽德罗常数的值,列出表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com