
【题目】根据以下信息书写反应方程式:
(1)Co3O4被认为在替代贵金属基催化剂中具有良好前景,利用钴渣[含Co(OH)3、Fe(OH)3等]制备CoC2O4的工艺流程如下:
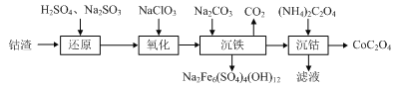
①写出“还原”中Co(OH)3反应的离子方程式: _______ 。
②写出“氧化”(ClO![]() 被还原为Cl-)中Fe2+反应的离子方程式: _______ 。
被还原为Cl-)中Fe2+反应的离子方程式: _______ 。
③写出“沉铁”反应的离子方程式: _______ 。
④NaClO3可以由惰性电极电解食盐水得到,写出该反应的化学方程式: _______ 。
(2)一种NH3催化还原NO的物质转化如图所示。若参与反应的NH3和O2的物质的量之比为4∶1,写出转化时总反应的化学方程式: _______ 。

【答案】2Co(OH)3+![]() +4H+=2Co2++
+4H+=2Co2++![]() +5H2O 6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 2Na++4
+5H2O 6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 2Na++4![]() +6Fe3++6
+6Fe3++6![]() +6H2O=Na2Fe6(SO4)4(OH)12↓+6CO2↑ NaCl+3H2O
+6H2O=Na2Fe6(SO4)4(OH)12↓+6CO2↑ NaCl+3H2O![]() NaClO3+3H2↑ 4NH3+4NO+O2
NaClO3+3H2↑ 4NH3+4NO+O2 4N2+6H2O
4N2+6H2O
【解析】
(1)根据题给信息分析流程可知,钴渣用H2SO4和Na2SO3处理后,钴和铁分别被还原为Co2+和Fe2+,再用NaClO3将Fe2+氧化为Fe3+,并在加入Na2CO3后形成沉淀而除去,Co2+则与(NH4)2C2O4反应生成产品CoC2O4。
(2)根据题意结合图可知,NH3、NO、O2被消耗,是反应物,生成的是N2和H2O,Fe2+、Fe3+循环反应,是催化剂,H+和-NH2 是中间产物;在此基础上,根据电子守恒、质量守恒可写出总反应的化学方程式。
(1)①“还原”中Co(OH)3被![]() 还原,离子方程式为:2Co(OH)3+
还原,离子方程式为:2Co(OH)3+![]() +4H+ = 2Co2++
+4H+ = 2Co2++![]() +5H2O。答案为:2Co(OH)3+
+5H2O。答案为:2Co(OH)3+![]() +4H+ = 2Co2++
+4H+ = 2Co2++![]() +5H2O
+5H2O
②“氧化”中NaClO3将Fe2+氧化为Fe3+,反应的离子方程式为:6Fe2++ClO3-+6H+ = 6Fe3++Cl-+3H2O。
③Fe3+在加入Na2CO3后形成Na2Fe6(SO4)4(OH)12沉淀,分析产物,应有Na+、![]() 、Fe3+、
、Fe3+、![]() 、H2O参加反应,根据电荷守恒、质量守恒可写出反应的离子方程式为:2Na++4
、H2O参加反应,根据电荷守恒、质量守恒可写出反应的离子方程式为:2Na++4![]() +6Fe3++6
+6Fe3++6![]() +6H2O=Na2Fe6(SO4)4(OH)12↓+6CO2↑。答案为:2Na++4
+6H2O=Na2Fe6(SO4)4(OH)12↓+6CO2↑。答案为:2Na++4![]() +6Fe3++6
+6Fe3++6![]() +6H2O=Na2Fe6(SO4)4(OH)12↓+6CO2↑
+6H2O=Na2Fe6(SO4)4(OH)12↓+6CO2↑
④由惰性电极电解食盐水制取NaClO3,阳极为Cl-→ClO3-,阴极为H2O →H2,该反应的化学方程式为:NaCl+3H2O![]() NaClO3+3H2↑。答案为:NaCl+3H2O
NaClO3+3H2↑。答案为:NaCl+3H2O![]() NaClO3+3H2↑
NaClO3+3H2↑
(2)根据分析可知,NH3、NO、O2是反应物,N2和H2O产物,由题可知,如果有4molNH3,则有1molO2,根据电子守恒质量守恒,NO的量应为4mol,由此可写出总反应的化学方程式为:4NH3+4NO+O2![]() 4N2+6H2O。答案为:4NH3+4NO+O2
4N2+6H2O。答案为:4NH3+4NO+O2![]() 4N2+6H2O
4N2+6H2O


科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
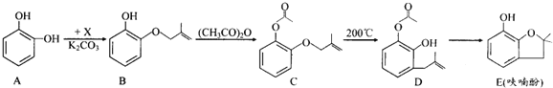
(1)A在空气中久置会由无色转变为棕褐色,其原因是____________,A在核磁共振氢谱中有___________组峰。
(2)B→C的反应类型是_____________________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:___________________。
(4)要鉴别化合物C和D,适宜的试剂是__________________________。
(5)B的同分异构体很多,符合下列条件的有______种,写出其中能发生银镜反应的同分异构体的结构简式:__________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.将CH3COONa溶液从20 ℃升温到30 ℃,溶液中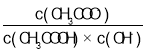 增大
增大
B.pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③
C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)是具有强还原性的弱酸,可以被银离子氧化为磷酸。1摩尔亚磷酸最多消耗2摩尔氢氧化钠。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________。
(2)Na2HPO3是____(填“正盐”或“酸式盐”) 。
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________。
(4)某温度下,0.10 molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2 molL-1,该温度下H3PO3的电离平衡常数K1=___________________;(结果保留两位有效数字)。
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能说明氯元素的非金属性比硫元素强的是( )
①![]() 比
比![]() 稳定
稳定
②![]() 氧化性比
氧化性比![]() 强
强
③![]() 酸性比
酸性比![]() 强
强
④![]() 能与
能与![]() 反应生成S
反应生成S
⑤![]() 与
与![]() 反应生成
反应生成![]() ,S与
,S与![]() 反应生成
反应生成![]()
A.①⑤B.②C.①④D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列各实验装置进行相应的实验,能达到实验目的的是
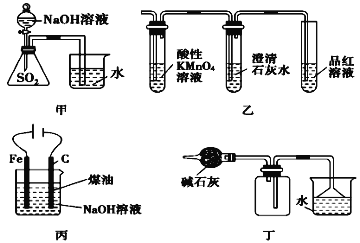
A. 用图甲装置证明SO2与NaOH溶液发生了反应
B. 用图乙装置检验某混合气体是否由SO2和CO2混合而成
C. 用图丙装置制备Fe(OH)2并能较长时间观察其颜色
D. 用图丁装置干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
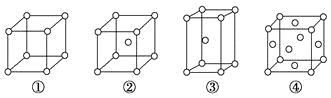
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,AG的定义为AG=lg![]() 。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是
。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是
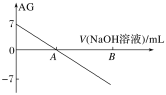
A.室温下,醋酸的电离常数约为10-5
B.A点时加入氢氧化钠溶液的体积为20.00 mL
C.若B点为40 mL,所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从A到B,水的电离程度逐渐变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com