
【题目】下列有关醛的说法正确的是
A.分子通式为CnH2nO的有机物与乙醛一定互为同系物
B.用溴水可以检验CH2=CHCHO中含有的碳碳双键
C.对甲基苯甲醛(![]() )可使酸性KMnO4溶液褪色,说明醛基具有还原性
)可使酸性KMnO4溶液褪色,说明醛基具有还原性
D.能发生银镜反应的有机物不一定是醛类
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】镁-次氯酸盐电池的工作原理如图,该电池反应为:
Mg+ClO-+H20=Mg(0H)2+Cl-。下列有关说法正确的是

A.电池工作时,正极a附近的pH将不断增大
B.电池工作时,C溶液中的溶质是MgCl2
C.负极反应式:ClO- +2e- +H20 = Cl- +20H-
D.b电极发生还原反应,每转移0.2mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为![]()
![]() ,请回答下列相关问题。
,请回答下列相关问题。
![]() 下表为部分键能数据,据此可算出
下表为部分键能数据,据此可算出![]() ___________
___________![]() 。
。
化学键 |
|
|
|
|
键能 | 332 | 611 | 414 | 436 |
![]() 一定温度下,向
一定温度下,向![]() 的密闭容器中充入
的密闭容器中充入![]() 发生脱氢反应,经过
发生脱氢反应,经过![]() 达到平衡状态,测得平衡时气体压强是开始的
达到平衡状态,测得平衡时气体压强是开始的![]() 倍。
倍。
![]() 内氢气的生成速率
内氢气的生成速率![]() _______,
_______,![]() 的平衡转化率为_______。
的平衡转化率为_______。
![]() 下列情况能说明该反应达到平衡状态的是____________
下列情况能说明该反应达到平衡状态的是____________![]() 填标号
填标号![]() 。
。
A.混合气体的平均相对分子质量保持不变 ![]() 与
与![]() 的物质的量之比保持不变
的物质的量之比保持不变
C.混合气体的密度保持不变 ![]() 的分解速率与
的分解速率与![]() 的消耗速率相等
的消耗速率相等
![]() 脱氢反应分别在压强为
脱氢反应分别在压强为![]() 和
和![]() 时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示:
时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示:
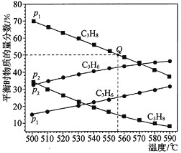
![]() 压强:
压强:![]() _________
_________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___________。
为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___________。
![]() 若
若![]() ,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数
,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数![]() _______
_______![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 实际生产中常在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氧反应,充入氩气的原因是______________。
实际生产中常在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氧反应,充入氩气的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是( )
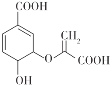
A.分子中含有2种含氧官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1 mol分枝酸最多可与3 mol NaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,其结构简式如图所示。下列有关叙述中正确的是()
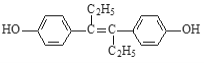
A.遇FeCl3溶液不能发生显色反应
B.可与NaOH和NaHCO3溶液发生反应
C.1mol该有机物可以与5molBr2发生反应
D.己烯雌酚分子中一定有16个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp(单位省略) | 1.8×10-10 | 1.5×10-16 | 6.3×10-50 |
下列叙述错误的是 ( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。已知:溴乙烷及1-溴丁烷均难溶于水且二者在氢氧化钠作用下会发生水解反应。实验室制备溴乙烷和 1溴丁烷的反应如下:
NaBr+H2SO 4 =HBr+NaHSO4 ①
R—OH+HBr→ R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br- 被浓硫酸氧化为 Br2等。有关数据列表如下:
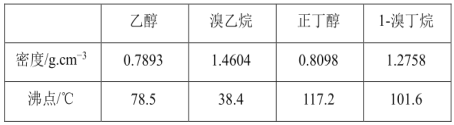
请回答下列问题:
(1)在蒸馏过程中,仪器选择及安装都正确的是____________(填标号)。
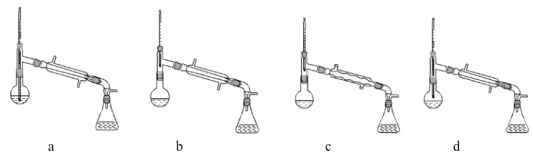
(2)醇的水溶性______(填“大于”、“等于”或“小于”)相应的溴代烃。
(3)将 1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,水在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.水是反应的催化剂 b.减少 Br2 的生成
c.减少 HBr 的挥发 d.减少副产物烯和醚的生成
(5)欲除去溴乙烷中的少量杂质 Br 2 ,下列物质中最适合的是________(填字母)。
a.NaI b.KCl c.NaOH d.NaHSO 3
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_______;但在制备 1溴丁烷时却不能边反应边蒸出产物,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元锂电池是以镍、钴、锰为正极材料的新型电池,镍、钴、锰材料可表示为Li1-nNixCoyMnzO2,x+y+z=1,通常简写为Li1-n MO2,Ni、Co、 Mn 三种元素分别显+2、+3、+4价。其充电时总反应为:LiMO2 +C6![]() Li1-nMO2+LinC6,下列说法错误的是
Li1-nMO2+LinC6,下列说法错误的是
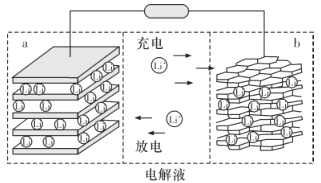
A.放电时电子从b电极由导线移向a电极
B.在Li1-nMO2材料中,若x:y:z=2:3:5,则n=0.3
C.放电时,正极反应为:Li1- nMO2+nLi++ne - =LiMO2
D.充电时,当转移0.2mol电子,负极材料减重1.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
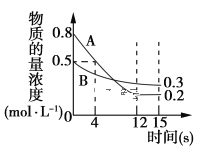
(1)从反应开始到12 s时,用A表示的反应速率为________。
(2)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为______________。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1;乙:v(B)=0.12 mol·L-1·s-1;丙:v(C)=9.6 mol·L-1·min-1;则甲、乙、丙三个容器中反应速率由快到慢的顺序为________。
(4)下表所列数据是反应CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)![]() H1在不同温度下的化学平衡常数(K)。
H1在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断![]() H1_______0(填“>”“=”或“<”);
H1_______0(填“>”“=”或“<”);
②某温度下,将2molCO和6molH2充入2L密闭容器,充分反应,达平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为__________,此时的温度为_______________从上表中选择)
(5)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4(g)+3/2O2(g)![]() CO(g)+2H2O(g)
CO(g)+2H2O(g)![]() H=-519kJ·mol-1。工业上,为选择合适的催化剂,分别对X、Y、Z三 种催化剂进行了如下实验(其他条件相同)
H=-519kJ·mol-1。工业上,为选择合适的催化剂,分别对X、Y、Z三 种催化剂进行了如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1> T2> T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是__(填“X”、“Y”或“Z”)选择的理由是_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com