
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g) ![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示: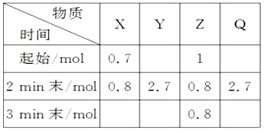
已知2 min内v(Q)=0.075 mol·L-1·min-1 , v(Z)∶v(Y)=1∶2。
(1)试确定:起始时n(Y)= , n(Q)=。
(2)方程式中m= , n= , p= , q=。
(3)用Z表示2 min内的反应速率。
【答案】
(1)2.3 mol,3 mol
(2)1,4,2,3
(3)0.05 mol·L-1·min-1
【解析】2min钟内v(Q)=0.075 mol·L-1·min-1,则△n(Q)=0.075mol·L-1·min-1×2min×2L=0.3mol,根据表中数据可知,2min内X的物质的量变化为:△n(X)=0.8mol-0.7mol=0.1mol,Z的物质的量变化为△n(Z)=1mol-0.8mol=0.2mol,根据反应速率v(Z)∶v(Y)=1∶2可知,Y的物质的量的变化为△n(Y)=2△n(Z)=0.4mol,反应方程式中物质的量的变化与其化学计量数成正比,则:m:n:p:q=0.1mol:0.4mol:0.2mol:0.3mol=1:4:2:3,所以m=1、n=4、p=2、q=3,反应方程式是:X(g)+4Y(g) ![]() 2Z(g)+3Q(g)。
2Z(g)+3Q(g)。
(1)2min内生成0.1molX,根据X(g)+4Y(g) ![]() 2Z(g)+3Q(g)可知,2min内生成Y的物质的量是0.4mol,则起始时Y的物质的量为:2.7mol-0.4mol=2.3mol;Q在2min内减少了△n(Q)=0.075mol·L-1·min-1×2min×2L=0.3mol,所以Q的起始物质的量是2.7mol+0.3mol=3mol,
2Z(g)+3Q(g)可知,2min内生成Y的物质的量是0.4mol,则起始时Y的物质的量为:2.7mol-0.4mol=2.3mol;Q在2min内减少了△n(Q)=0.075mol·L-1·min-1×2min×2L=0.3mol,所以Q的起始物质的量是2.7mol+0.3mol=3mol,
故答案是2.3 mol;3 mol。
(2)根据以上分析可知,m=1、n=4、p=2、q=3,
故答案是:1;4;2;3。
(3)2min内消耗的Z的物质的量是n(Z)=1mol-0.8mol=0.2mol,则用Z表示2min内的反应速率是:v(Z)= ![]() =0.05mol·L-1·min-1,
=0.05mol·L-1·min-1,
故答案是:0.05mol·L-1·min-1。
【考点精析】认真审题,首先需要了解反应速率的定量表示方法(反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t).


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2═4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此段时间内,该反应的速率v可表示为( )
A.v(NH3)=0.010mol/(L.s)
B.v(O2)=0.010mol/(L.s)
C.v(NO)=0.0010mol/(L.s)
D.v(H2O)=0.045mol/(L.s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l)△H1=﹣1301.0kJmol﹣1
O2(g)═2CO2(g)+H2O(l)△H1=﹣1301.0kJmol﹣1
②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(1)△H3=﹣285.8kJmol﹣1
O2(g)═H2O(1)△H3=﹣285.8kJmol﹣1
则反应④2C(s)+H2(g)═C2H2(g)的△H为( )
A.+228.2 kJmol﹣1
B.﹣228.2 kJmol﹣1
C.+1301.0 kJmol﹣1
D.+621.7 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
已知在常温常压下,甲醇、CO的燃烧热分别是726.5kJ·mol-1、110.5 kJ·mol-1。写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____;
(2)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g) +Cl2(g) ![]() COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
t/min | n(CO)/mol | n(Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应0~2min末的平均速率v(COCl2)=__________mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =______。
③已知X、L可分别代表温度或压强,下图表示L一定时,CO的 转化率随X的变化关系。X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。

(3)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g)![]() 2CO2 (g)+N2 (g)
2CO2 (g)+N2 (g)
ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是____________________。
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为______________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式_______________。
(4)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g) ![]() CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,反应aX(g) ![]() bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( )
bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( )
A.a>b+c
B.a<b+c
C.a=b+c
D.a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于3个不同短周期的主族元素a、b、c、d、e,原子序数依次增大,其中b、d同主族,d元素最高化合价与最低化合价代数和等于4,c原子最外层电子数比b原子次外层电子数多1,回答下列问题。
(1)写出a的元素符号_____,b在周期表中的位置是第___周期____族;
(2)a与e形成的是_____(填“离子”或“共价”)化合物;
(3)上述五种元素中,非金属性最强的是______(填元素名称);
(4)d元素最高价氧化物对应水化物的化学式是______,d和e的气态氢化物稳定性强的是_________(填化学式);
(5)元素c的原子结构示意图为____;c的单质与a的同主族第3周期元素最高价氧化物对应水化物反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,极微溶于水,不溶于醇类。可与水缓慢反应,易与酸反应。实验室通常用CaCl2在碱性条件下与H2O2反应制得(该反应剧烈并大量放热),装置如图所示,请回答下面的问题:
I.CaO2的制备

(1)漏斗在使用时其上口的玻璃塞应________(填“打开”或“关闭”),支管B的作用是________。
(2)将盛有浓CaCl2溶液的装置置于冰水混合物中。其原因是:使反应平稳进行、___________。
(3)加入H2O2与浓氨水的混合溶液,使反应开始。
①反应的化学方程式是_______________。
②滴加H2O2与浓氨水混合溶液之前,还应进行的操作是______。
(4)待反应结束后,经______(填操作)得CaO2粗产品。
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量。
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度__________。
实验序号 | ① | ② | ③ | ④ |
消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
(6)测得CaO2样品的纯度偏低,其原因可能是______(选填编号)。
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com