
【题目】有下列各组物质:①![]() 和
和![]() ;②石墨和足球烯;③漂白粉和漂白液主要成分
;②石墨和足球烯;③漂白粉和漂白液主要成分
④正丁烷和异庚烷;⑤乙烯和聚乙烯;⑥![]() 和
和 ;⑦丙烷和环丙烷
;⑦丙烷和环丙烷
⑧CH3-CH2-CH2-CH3 和CH3-CH(CH3)CH3。用序号填空:
(1)____________组两者互为同位素。
(2)____________组两者互为同素异形体。
(3)____________组两者属于同系物。
(4)____________组两者互为同分异构体。
(5)____________组两者是同一物质。
【答案】① ② ④ ⑧ ⑥
【解析】
质子数相同,中子数不同或同一元素的不同核素互为同位素;
同种元素形成的不同种单质间互为同素异形体;
结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物;
具有相同分子式而结构不同的化合物互为同分异构体;
分子式相同、结构也相同的物质为同一种物质,据此分析。
①![]() 和
和![]() 是同一元素的质子数相同而中子数不同的原子,互称为同位素;
是同一元素的质子数相同而中子数不同的原子,互称为同位素;
②石墨和和足球烯是同一元素形成的不同性质的单质,互称为同素异形体;
③漂白粉的主要成分为次氯酸钙和氯化钙,而漂白液主要成分为次氯酸钠和氯化钠,两者之间无关系;
④正丁烷和异庚烷都是烷烃,结构相似,在分子组成上相差3个CH2原子团的化合物,是同系物;
⑤乙烯发生加聚反应生成聚乙烯,即乙烯是聚乙烯的单体,两者间无上述任何关系;
⑥是二溴甲烷的在平面的两种表示,属于同一物质;
⑦丙烷属于烷烃,环丙烷属于环烷烃,两者之间无关系;
⑧CH3-CH2-CH2-CH3和 CH3-CH(CH3)CH3分子式相同结构不同,是同分异构体;
(1)①126C和136C组两者互为同位素,
故答案为:①;
(2)②石墨和和足球烯组两者互为同素异形体,
故答案为:②;
(3)④正丁烷和异庚烷组两者属于同系物,
故答案为:④;
(4)⑧CH3-CH2-CH2-CH3和CH3-CH(CH3)CH3组两者互为同分异构体,
故答案为:⑧;
(5)⑥![]() 和
和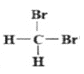 组两者是同一物质,
组两者是同一物质,
故答案为:⑥。


科目:高中化学 来源: 题型:
【题目】近年来环境问题突出,大气污染更为严重。回答下面问题
(1)下列选项中属于重点城市空气质量日报首要污染物的是_____
A.CO2 B.SO2 C.可吸入颗粒物 D.H2S
(2)汽车尾气常含有CO、NO等有毒气体,汽车气缸中生成NO的化学方程式是___________
(3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下(以Pt催化剂为例)
I:NO+Pt(S)=NO(S)(Pt(S)表示催化剂,NO(S)表示吸附态NO,下同)
II:CO+Pt(S)=CO(S)
III:NO(S)=N(S)+O(S)
IV:CO(S)+O(S)=CO2+2Pt(S)
V:N(S)+N(S)=N2+2Pt(S)
VI:NO(S)+N(S)=N2O+2Pt(S)
尾气中反应物及生成物浓度随温度的变化关系如下图。

回答下面问题
①汽车尾气消污反应最适宜的反应温度是____
A. 250℃ B.300℃ C.330℃ D.400℃
②330℃以下的低温区发生的主要反应的化学方程式是___________
③低温区N2O选择性高于N2,由此可推断出:V反应的活化能____Ⅵ反应的活化能(填
“<”、“>”或“=”),理由是_______________
④结合反应机理和图像温度位于330℃—400℃时,升高温度,V反应的反应速率_____,(填“增大”、“减小”或“不变”,下同),Ⅳ反应的反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是

A. P4分子中P原子均满足8电子稳定结构
B. 反应中NaOH作还原剂
C. 该反应能自发进行,则ΔS<0
D. 反应中生成1 mol NaH2PO2,转移电子数目为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
□Fe2+ +□____+□ + □H2O=□ Fe(OH)3 +□HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验 IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
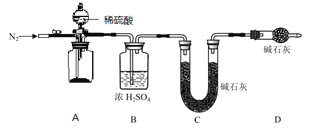
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的应用和发展与人类文明的进步紧密相关,下列关于材料的说法正确的是( )
A.普通玻璃是合成材料B.玻璃钢是无机非金属材料
C.有机玻璃是一种常见的塑料D.有机玻璃是复合材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
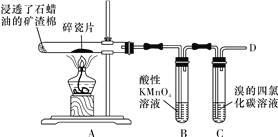
(1)A中碎瓷片的作用是____________。
(2)乙烯的电子式为__________________。
(3)下列物质中,可以通过乙烯的加成反应得到的是______(填字母代号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)运输水果时,为了吸收水果产生的乙烯,防止水果早熟腐烂,常将浸泡有_______溶液的硅藻土放置在盛放水果的容器中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,说明氨水中含有NH4+
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3具有热不稳定性
D. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO
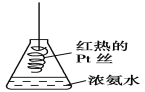
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com