
| A、若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小 |
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a |
| D、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、含有碳碳双键的有机物均有顺反异构 |
| B、乙烯和聚乙烯均能使酸性KMnO4溶液褪色 |
| C、利用电石与水反应制取C2H2时,可采用CuSO4溶液除去杂质气体 |
| D、苯酚与甲醇在酸性条件下聚合生成酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离度α(25℃)>α(35℃) |
| B、c(H+)随着温度的降低而升高 |
| C、在35℃时,纯水中c(H+)>c(OH-) |
| D、水的电离过程是吸热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
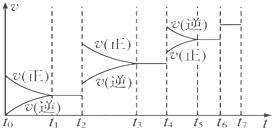
查看答案和解析>>
科目:高中化学 来源: 题型:
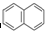 ②
② ③
③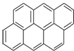 ④
④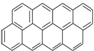 …该系列化合物中所含碳的质量分数最大值是( )
…该系列化合物中所含碳的质量分数最大值是( )| A、93.8% | B、95.7% |
| C、97.3% | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光化学烟雾是氮氧化物受紫外线照射后与空气中的…些碳氢化合物作用后生成的一种有毒烟雾 |
| B、“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 |
| C、绿色化学的核心是应用化学原理对环境污染进行治理 |
| D、航天飞机上使用的隔热陶瓷瓦,大多是以碳纤维做增强体的新型复合材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g Fe投入100 mL 3.5mol?L-1稀硝酸中,充分反应,转移电子总数为0.3 NA |
| B、常温常压下,100g 17% H2O2水溶液含氧原子总数为NA |
| C、苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA |
| D、2.24 L NH3中含共价键数目一定为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com