
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小 |
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a |
| D、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COOH)与c(CH3COO-)之和始终保持不变 | ||||
| B、当加入氨水的体积为10 mL时c(NH4+)=c(CH3COO-) | ||||
| C、水的电离程度始终增大 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1molNaOD溶于重水制成1L溶液,pD=13 |
| B、将pD=4的DCl的重水溶液稀释100倍,所得溶液pD=6 |
| C、向30mL0.5mol?L-1NaOD的重水溶液中加入20mL0.5mol?L-1DCl的重水溶液,所得溶液pD=13 |
| D、pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 氖 氖 |
B、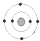 碳 碳 |
C、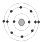 镁 镁 |
D、 硫 硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8 | B、9 | C、10 | D、11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2为0.2 mol?L-1 |
| B、Y2为0.2 mol?L-1 |
| C、Z为0.3 mol?L-1 |
| D、Z为0.45 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 |
| B、HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
| C、HF、CH3CH2OH、KOH都易溶于水,都是电解质 |
| D、HCOOH、H2CO3、H2S分子中均含有两个氢原子,都是二元酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com