
| A、X2为0.2 mol?L-1 |
| B、Y2为0.2 mol?L-1 |
| C、Z为0.3 mol?L-1 |
| D、Z为0.45 mol?L-1 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝是电解质,可电解其水溶液获得金属铝 |
| B、二氧化硅具有导电性,可用于生产光导纤维 |
| C、SO2具有漂白性,可用于将银耳漂白为“雪耳” |
| D、小苏打可与酸反应,可用作治疗胃酸过多的药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
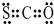
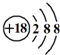

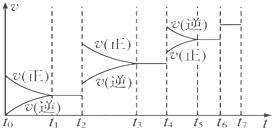
20 17 |
| A、①④⑤ | B、②③④⑥ |
| C、③⑤⑥⑦ | D、全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g Fe投入100 mL 3.5mol?L-1稀硝酸中,充分反应,转移电子总数为0.3 NA |
| B、常温常压下,100g 17% H2O2水溶液含氧原子总数为NA |
| C、苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA |
| D、2.24 L NH3中含共价键数目一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液跟稀硝酸反应 HCO3-+H+=H2O+CO2↑ |
| B、硫酸铜与氢氧化钡溶液混合:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓ |
| C、向稀氨水中加入稀盐酸 NH3?H2O+H+=NH4++H2O |
| D、碳酸钙溶于醋酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com