
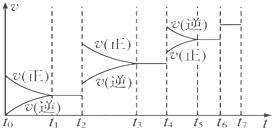
| [CO]?[H2] |
| [H2O] |
| [CO]?[H2] |
| [H2O] |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
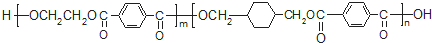
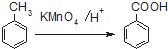
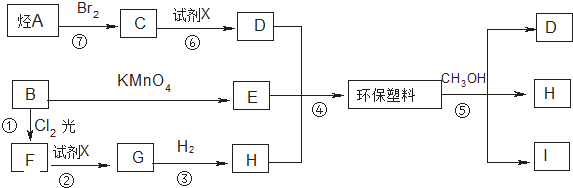
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇和浓硫酸混合加热,制乙烯 |
| B、从石油中提炼汽油 |
| C、用蒸馏方法提纯水 |
| D、实验室制取溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
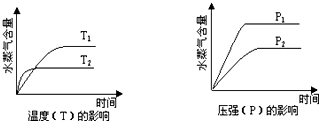
| A、CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g);△H<0 |
| B、2C6H5CH2CH3(g)+O2(g) 2C6H5CH=CH2(g)+2H2O(g);△H<0 |
| C、CH3CH2OH(g) CH2=CH2(g)+H2O(g);△H>0 |
| D、CO2(g)+H2(g) CO(g)+H2O(g);△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小 |
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a |
| D、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COOH)与c(CH3COO-)之和始终保持不变 | ||||
| B、当加入氨水的体积为10 mL时c(NH4+)=c(CH3COO-) | ||||
| C、水的电离程度始终增大 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2为0.2 mol?L-1 |
| B、Y2为0.2 mol?L-1 |
| C、Z为0.3 mol?L-1 |
| D、Z为0.45 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com