
【题目】某兴趣小组欲制备漂白剂亚氯酸钠(NaClO2)。甲同学通过查阅文献发现:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
实验I 乙同学利用下图所示装置制取NaClO2晶体

(l)装置B中盛装浓硫酸的仪器名称是______,装置A和E的作用是__________。
(2)装置D中发生反应的化学方程式为_____________________________________。
(3)反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶,然后进行的操作是_______,再用38℃~60℃的温水洗涤,最后在低于60℃条件下干燥,得到NaClO2晶体。
实验Ⅱ 丙同学设计实验测定制得NaClO2样品的纯度
其实验步骤如下:
① 称取所得亚氯酸钠样品ag于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应后,配成100mL混合液。
② 取25.00 mL待测液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,消耗标准液体积的平均值为VmL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)步骤① 反应的离子方程式为____________________________________。
(5)步骤② 滴定中使用的指示剂是____________________。
(6)样品中NaClO2的质最分数为______________(用含a、b、V的代数式表示)。
【答案】 分液漏斗 吸收ClO2,防止污染空气 2NaOH +2ClO2+ H2O2=2NaClO2+2H2O+O2↑ 趁热过滤 ClO2-+4I-+4H+=2H2O+2I2+Cl- 淀粉溶液 ![]()
【解析】试题分析:本题考查NaClO2晶体的制备,物质纯度的测定和滴定实验。
(1)装置B中盛浓H2SO4的仪器为分液漏斗。装置B用于制备ClO2,装置B中反应的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,装置A和E中的NaOH用于吸收ClO2,防止污染空气。
(2)装置D中ClO2与NaOH和H2O2的混合溶液反应制备NaClO2,ClO2被还原成NaClO2,则H2O2被氧化成O2,写出反应ClO2+NaOH+H2O2→NaClO2+O2↑+H2O,用化合价升降相等和原子守恒可配平得化学方程式为2NaOH +2ClO2+ H2O2=2NaClO2+2H2O+O2↑。
(3)由于NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,所以反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶(温度控制55℃的目的是防止温度高于60℃NaClO2分解成NaClO3和NaCl),然后进行的操作是趁热过滤(防止温度低于38℃时析出NaClO2·3H2O)。
(4)根据实验步骤分析,步骤①为NaClO2在酸性条件下将KI氧化成I2,自身还原成Cl-,反应为ClO2-+I-+H+→Cl-+I2+H2O,用化合价升降相等可得ClO2-+4I-+H+→Cl-+2I2+H2O,结合原子守恒和电荷守恒,写出离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O。
(5)由于用Na2S2O3滴定I2,I2遇淀粉呈特征的蓝色,所以选用淀粉溶液作指示剂,实验终点的实验现象为:滴入一滴Na2S2O3溶液,溶液由蓝色褪为无色且在30s内不恢复。
(6)根据反应写出关系式:NaClO2~2I2~4Na2S2O3,n(NaClO2)=n(Na2S2O3)/4=bV![]() 10-3/4mol,原样品中NaClO2物质的量为bV
10-3/4mol,原样品中NaClO2物质的量为bV![]() 10-3/4mol
10-3/4mol![]() = bV
= bV![]() 10-3mol,质量为90.5bV
10-3mol,质量为90.5bV![]() 10-3g,样品中NaClO2的质量分数为
10-3g,样品中NaClO2的质量分数为![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是
A. 任何非金属单质分子中一定含有共价键
B. 离子化合物中可能存在共价键,共价化合物中也可能存在离子键
C. 离子化合物中可能存在共价键,但共价化合物中一定不存在离子键
D. MgF2中既含有离子键又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的叙述正确的是
A.苯和乙烯都能使溴水褪色,且反应原理相同
B.乙烯和氯乙烯都可以通过聚合反应得到高分子材料
C.用乙烷或乙烯制备氯乙烷的反应类型完全相同
D.苯甲醇与苯酚均能与Na反应,两者是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废料中主要含有Al2O3、Co2O3CoO、少量Fe3O4等金属氧化物(Co2O3CoO不与强碱反应).实验室科技人员欲将之分离并制备相关物质,设计流程如下: 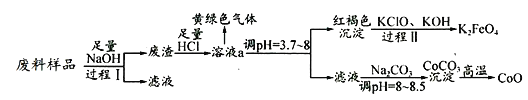
(1)过程Ⅰ中的操作名称是__,写出过程Ⅰ发生反应的化学方程式____________.
(2)溶液a中含有金属离子有 _________________.
(3)溶液a中逸出的黄绿色气体是氯气,下列说法不正确的是_________.
①氯气是有漂白性的酸性气体
②液氯和氯水均为液体,且都含有氯分子
③将氯气通入碱液时,氯气既是氧化剂,又是还原剂
④次氯酸见光易分解,说明次氯酸是弱酸
⑤向氯水中滴硝酸银溶液,有白色沉淀生成,说明氯水中含Cl-
(4)写出过程Ⅱ发生反应的离子方程式:_______________________________.
高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
则充电时阳极反应式为___________________________________.
(5)Co可以形成CoC2O42H2O(M为183g/mol),5.49g该晶体在空气中加热,在不同温度下分别得到一种固体物质,其质量如表:
温度范围(℃) | 固体质量(g) |
150﹣210 | 4.41 |
290﹣320 | 2.41 |
890﹣920 | 2.25 |
经测定,210℃~290℃过程中,产生的气体只有CO2,则此过程发生的化学反应方程式为:______________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]目前半导体生产正在进行一场“铜芯片”革命:在硅芯片上用铜代替铝布线。古老的金属铜在现代科技应用上取得了突破。用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
![]()
(1)基态铜原子的价电子排布式为____________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是_________,其立体结构是________,与该分子互为等电子体的单质气体的化学式是 。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液![]() 蓝色沉淀
蓝色沉淀![]() 沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为 ;
沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为 ;
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。铜晶体中铜原子堆积模型为________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________pm。(用含d和NA的式子表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于离子反应,又属于氧化还原反应的放热反应是( )
A. 铝片与稀盐酸反应 B. 灼热的碳与CO2反应
C. Ba(OH)2·8H2O与NH4Cl固体反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. υ(A)=0.5mol/(L·s) B. υ(B)=0.3mol/(L· s) C. υ(C)=0.8mol/(L·s) D. υ(D)=1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实 | 用CCl4提取 | 除去乙醇中的苯酚 | 从KI和I2的固体 | 配制100mL 0.1000 |
装 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com