
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实 | 用CCl4提取 | 除去乙醇中的苯酚 | 从KI和I2的固体 | 配制100mL 0.1000 |
装 |
|
|
|
|
A.A
B.B
C.C
D.D
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组欲制备漂白剂亚氯酸钠(NaClO2)。甲同学通过查阅文献发现:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
实验I 乙同学利用下图所示装置制取NaClO2晶体

(l)装置B中盛装浓硫酸的仪器名称是______,装置A和E的作用是__________。
(2)装置D中发生反应的化学方程式为_____________________________________。
(3)反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶,然后进行的操作是_______,再用38℃~60℃的温水洗涤,最后在低于60℃条件下干燥,得到NaClO2晶体。
实验Ⅱ 丙同学设计实验测定制得NaClO2样品的纯度
其实验步骤如下:
① 称取所得亚氯酸钠样品ag于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应后,配成100mL混合液。
② 取25.00 mL待测液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,消耗标准液体积的平均值为VmL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)步骤① 反应的离子方程式为____________________________________。
(5)步骤② 滴定中使用的指示剂是____________________。
(6)样品中NaClO2的质最分数为______________(用含a、b、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A. Al在氧气中燃烧生成Al2O3,将铝粉改为铝片
B. Fe与稀硫酸反应制取H2时,改用质量分数为98.3%的浓硫酸
C. Zn与稀硫酸反应时,适当提高溶液的温度
D. Na与水反应时增大水的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在容积均为0.5L的两个密闭容器中发生:2A(g)+B(g)2C(g)△H=﹣Q kJ/mol (Q>0),6min后,容器①中反应达平衡,有关数据如下表,下列叙述中正确的是
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
A. 0-6min,v(A)=0.25mol/(L·min)
B. ②中达平衡时放出的热量为0.05QkJ
C. 其他条件不变,若容器②保持绝热恒容,则达到平衡时C的体积分数小于2/3
D. 若①达平衡后,再通入1molA与0.5molB,再达平衡时A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产生活息息相关,下列性质与应用不存在因果关系的是( )
A. 石墨有金属光泽,可用来做干电池的电极
B. 活性炭具有吸附性,可用于吸附装修产生的有害气体
C. 氢氧化钠能与油脂反应,在生活中可用来除油污
D. 熟石灰具有碱性,可用于改良酸性土壤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知新型中温全瓷铁—空气电池,其结构简式如图所示。下列说法正确的是
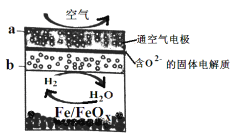
A. 铁表面发生的反应为 xH2O(g)+Fe=FeOx+xH2
B. a 极发生氧化反应
C. 正极的电极反应为 FeOx+2xe- =Fe+xO2-
D. 若有 22.4L(标准状况 )空气参与反应,则电路中有 4mol 电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K4Fe(CN)6(亚铁氰化钾)可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛应用。以某电镀厂排放的含NaCN废液为主要原料制备K4Fe(CN)6的流程如下。已知:常温下,HCN的Ka=6.2×10-10,回答下列问题:

(1)HCN的电离方程式为______________;实验室配制一定浓度的NaCN溶液时,常将NaCN溶解于一定浓度的_______溶液中,加水稀释至指定浓度。
(2)反应器中发生的主要反应的化学方程式为______________。
(3)过滤后,洗涤K4Fe(CN)6使用的试剂为__________。
(4)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],生成的盐又可用于治疗Ti2SO4中毒,试写出上述治疗Ti2SO4中毒反应的离子方程式为_____________。
(5)一种太阳能电池的工作原理如图,电解质为K3Fe(CN)6和K4Fe(CN)6的混合溶液。

①则K+移向催化剂_________(填“a”或“b”);
②催化剂a表面发生的电极反应为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁为四种主族元素,已知甲与乙、丙、丁三元素相邻;甲、乙的原子序数之和等于丙的原子序数,四种元素原子的最外层电子数之和为20。下列判断中,正确的是
A. 原子半径:丙>乙>甲 B. 最外层电子数:丙=丁
C. 气态氢化物的稳定性:甲>丙 D. 最高价氧化物对应的水化物的酸性:丁>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________、_______。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com