
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是

A. 该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B. Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+
C. Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
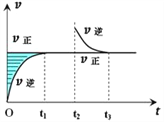
A. Z和W在该条件下一定不为气态
B. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等
D. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,通过置换反应得到铁的是
A. 铜浸入氯化铁溶液中
B. 一氧化碳通过炽热的氧化铁
C. 铝与氧化铁混合物加热至高温
D. 铜浸入氯化亚铁溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_____________________________________________________
(2)反应中若产生0.2mol气体,则转移电子的物质的量是____________mol。
(3)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:________________________________________________________。
Ⅱ、某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是_____________。
(2)写出该反应的化学方程式________________________________________________________________________。
(3)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用石墨电极电解2.0 L,2.5 mol/L CuSO4溶液,如有0.2 mol电子发生转移,试回答下列问题:
(1)阴极发生______ 反应,电极反应为________________。
(2)阳极电极反应为_____________________________ 。
(3)电解后得到的Cu的质量是________ ,得到O2的体积(标准状况)是________ 。
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差____ ,电解液的pH________ (填“变小”、“变大”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 46 g NO2 和N2O4 混合气体中的氧原子数为 2NA
B. 1 mol N2 与 4 mol H2 反应生成的 NH3 分子数为 2NA
C. 1 mol Fe 和 1 mol Cl2 充分反应,电子转移数为 3NA
D. 标准状况下,2.24 LCCl4 含有的共价键数为 0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com