
【题目】I、氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_____________________________________________________
(2)反应中若产生0.2mol气体,则转移电子的物质的量是____________mol。
(3)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:________________________________________________________。
Ⅱ、某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是_____________。
(2)写出该反应的化学方程式________________________________________________________________________。
(3)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________________。
【答案】14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O0.6mol使用了较浓的硝酸,产物中有部分二氧化氮生成H2O22H2CrO4+3H2O2═2Cr(OH)3+3O2↑+2H2O3.36L
【解析】
I、(1)NO3-+4H++3e→NO+2H2O,该反应中硝酸发生还原反应,所以另一种物质必须具有还原性,只有Cu2O符合,与硝酸发生氧化还原反应生成NO和Cu(NO3)2,反应的方程式为HNO3+Cu2O→Cu(NO3)2+NO↑+H2O,Cu元素的化合价升高,N元素的化合价降低,由电子、原子守恒可知,反应方程式为14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O;
(2)该反应中,14mol HNO3反应,其中2mol被还原,得到6mol电子,生成2molNO,所以若产生0.2mol气体,则转移电子的物质的量为0.6mol;
(4)Cu2O+6HNO3(浓)═2Cu(NO3)2+2NO2↑+3H2O …①,
14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O …②,
将②式子系数除以3得到![]() HNO3+Cu2O═2Cu(NO3)2+
HNO3+Cu2O═2Cu(NO3)2+![]() NO↑+
NO↑+![]() H2O,可知用稀硝酸氧化1molCu2O需要
H2O,可知用稀硝酸氧化1molCu2O需要![]() mol硝酸作氧化剂,用浓硝酸需要2mol硝酸作氧化剂,质量当然增加,答案为使用了较浓的硝酸,产物中有部分二氧化氮生成;
mol硝酸作氧化剂,用浓硝酸需要2mol硝酸作氧化剂,质量当然增加,答案为使用了较浓的硝酸,产物中有部分二氧化氮生成;
Ⅱ、(1)由信息H2O2→O2中可知,O元素的化合价由-1价升高到0,则H2O2为还原剂;
(2)由信息H2O2→O2中可知,该反应中O元素失电子,Cr元素得到电子,2molH2CrO4反应转移电子为2mol×(6-3)=6mol,再结合质量守恒可进行配平可得反应方程式为2H2CrO4+3H2O2═2Cr(OH)3+3O2↑+2H2O;
(4)由2H2CrO4+3H2O2═2Cr(OH)3+3O2↑+2H2O可知,生成3mol气体转移6mol电子,则转移了0.3mol电子,则产生的气体的物质的量为![]() ×3mol=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L。
×3mol=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L。


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 化学反应中的能量变化都表现为热量变化
B. 凡是需要加热后才能发生的反应是吸热反应
C. 在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热
D. 物质发生化学反应都伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的各字母表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A是金属单质;B是淡黄色固体; C、D、E为无色气体,D能使湿润的红色石蕊试纸变蓝;H是无色液体。
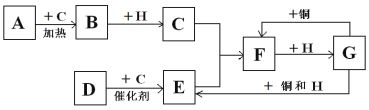
(1)写出下列各物质的化学式:B:________;F:_____。
(2)写出D→E反应的化学方程式为:_______。
(3)写出G→F反应的离子方程式:______;若该反应中转移电子总数为9.03 ×1023 ,则被还原的G的物质的量为_____。
(4)写出实验室制取D的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修5:有机化学基础】
A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。

已知:![]() +‖
+‖![]()
![]() ;R—C≡N
;R—C≡N![]() R—COOH
R—COOH
回答下列问题:
(1)A的名称是______________,B含有的官能团的名称是________________(写名称)。
(2)C的结构简式为________________,D→E的反应类型为________。
(3)E→F的化学方程式为________________________________________。
(4)![]() 中最多有________个原子共平面。
中最多有________个原子共平面。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6∶1∶1的是_____________________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)。
合成路线流程图示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应M + N = P,如果温度每升高10℃,化学反应速率增加到3倍,在20℃时完成该反应的30%需要81 min,若将温度升高到40℃,完成该反应的30%需要时间为
A. 9 minB. 27 minC. 13.5 minD. 3 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是

A. 该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B. Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+
C. Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A 的化学式为 NH5,已知其熔融态能够导电,则下列有关说法不正确的是( )
A. 1 mol NH5 中含有 5 NA 个 N—H 键(设 NA 表示阿伏加德罗常数的值)
B. NH5 中既有共价键又有离子键
C. NH5 的电子式为![]()
D. NH5 与水反应的离子方程式为NH4++H-+H2O===NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持、加热仪器已略去,气密性已检验)。
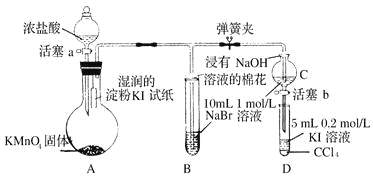
实验过程;
I.打开弹簧夹,打开活塞a,清加浓盐酸。II.当 B 和C 中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。Ⅳ……
(1)A中产生的是黄绿色气体,其离子方程式为____________,在该反应中浓盐酸表现了___________性。
(2)验证氯气的氧化性强于碘的实验现象是___________________________。
(3)B 中溶液发生反应的离子方程式是__________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________。
(5)过程Ⅲ实验的目的是__________________________。
(6)从元素周期表的递变规律的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com