
【题目】下图中的各字母表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A是金属单质;B是淡黄色固体; C、D、E为无色气体,D能使湿润的红色石蕊试纸变蓝;H是无色液体。
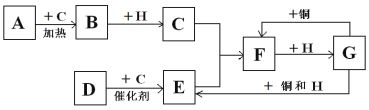
(1)写出下列各物质的化学式:B:________;F:_____。
(2)写出D→E反应的化学方程式为:_______。
(3)写出G→F反应的离子方程式:______;若该反应中转移电子总数为9.03 ×1023 ,则被还原的G的物质的量为_____。
(4)写出实验室制取D的化学方程式______
【答案】Na2O2 NO2 4NH3 + 5O2 ![]() 4 NO + 6H2O Cu+4H+ +2NO3-
4 NO + 6H2O Cu+4H+ +2NO3-![]() Cu2++2NO2↑+2H2O 1.5mol 2NH4Cl+Ca(OH)2
Cu2++2NO2↑+2H2O 1.5mol 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
A是金属单质、B是淡黄色固体,则A是Na、B是Na2O2、C是O2;D是气体,能使湿润的红色石蕊试纸变蓝,D是NH3;NH3催化氧化为NO,E是NO;NO与O2反应生成NO2,H是无色液体,H是H2O;NO2与H2O反应生成HNO3,G是HNO3。
(1)根据以上分析,B是过氧化钠,化学式是Na2O2;F是二氧化氮,化学式是NO2。
(2)氨气与氧气发生催化氧化反应生成NO和水,反应的化学方程式为4NH3 + 5O2 ![]() 4NO + 6H2O。
4NO + 6H2O。
(3)Cu与浓硝酸反应生成硝酸铜、二氧化氮、水,反应的离子方程式为Cu+4H+ +2NO3-![]() Cu2++2NO2↑+2H2O;硝酸被还原为NO2,若该反应中转移电子总数为9.03 ×1023 ,转移电子的物质的量是1.5mol,则被还原的硝酸的物质的量为1.5mol。
Cu2++2NO2↑+2H2O;硝酸被还原为NO2,若该反应中转移电子总数为9.03 ×1023 ,转移电子的物质的量是1.5mol,则被还原的硝酸的物质的量为1.5mol。
(4)实验室用加热氯化铵和氢氧化钙混合物的方法制取氨气,化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】通过卤素间的反应实验,可以比较出卤素单质氧化性的强弱。实验如下:

下列说法不正确的是
A. CCl4起到萃取、富集I2的作用
B. a中下层变无色,说明I2 转化为I-
C. Ⅲ中发生反应的离子方程式为:Br2 + 2I-=== I2 + 2Br-
D. 依据a、b中现象,可以证明Cl2的氧化性比 Br2强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
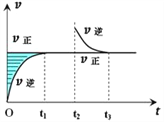
A. Z和W在该条件下一定不为气态
B. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等
D. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Fe3+、CO32-、SO42-、NO3-中的几种,且各种离子浓度相等。加入铝片,产生H2。下列说法正确的是
A. 向原溶液中加入Cu片发生:3Cu+8H++2NO3-=3Cu2++4H20+2NO↑
B. 向原溶液中加入过量氨水发生:Fe3++H++4NH3·H2O=Fe(OH)3↓+4NH4+
C. 向原溶液中加入过量Ba(OH)2溶液发生:Ba2++20H-+SO42-+NH4++H+=NH3·H2O +BaSO4↓+H2O
D. 向原溶液中加入BaCl2溶液发生:2Ba2++CO32-+SO42-=BaCO3↓+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀H2SO4 和稀HNO3的混合液1L,其物质的量浓度分别为0.4mol·L-1和0.1mol·L-1。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A. 2.4gB. 3.2gC. 6.4gD. 9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,通过置换反应得到铁的是
A. 铜浸入氯化铁溶液中
B. 一氧化碳通过炽热的氧化铁
C. 铝与氧化铁混合物加热至高温
D. 铜浸入氯化亚铁溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_____________________________________________________
(2)反应中若产生0.2mol气体,则转移电子的物质的量是____________mol。
(3)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:________________________________________________________。
Ⅱ、某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是_____________。
(2)写出该反应的化学方程式________________________________________________________________________。
(3)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com