
(1)某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
| A.把盛有溶液的分液漏斗敖在铁架台的铁圈中: |
| B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞: |
| C.检验分液漏斗活塞和上口玻璃塞是否漏液; |
| D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞: |
(1)CBDAHGEF(3分)
(2)溶液由无色变为紫色(2分) Cl2(2分,答HClO或HClO3也给分)
(3)①10NaBiO3+4MnSO4+14H2SO4=3Na2SO4+5Bi2(SO4)3+4NaMnO4+14H2O;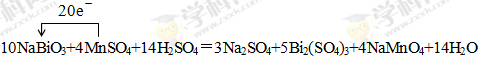 (3分,配平2分,电子转移的方向和数目1分,短线未改成等号的扣1分) ②Bi2(SO4)3(2分)
(3分,配平2分,电子转移的方向和数目1分,短线未改成等号的扣1分) ②Bi2(SO4)3(2分)
解析试题分析:(1)实验前应检查分液漏斗否漏液,加入溶液后,盖好玻璃塞,倒转漏斗,要用力振荡,让溶液充分混合,使溶质充分萃取到萃取剂中,并不时旋开活塞放气,最后关闭活塞。把盛有溶液的分液漏斗放在铁架台的铁圈中,静置分层,溶液分层后,为使漏斗内外气压相等,使液体顺利流下,应将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔,旋开活塞,用烧杯接收溶液。为防止有杂质,上层液体从上口流出,下层液体从下口流出.故正确操作步骤的顺序是CBDAHGEF。
(2)由反应可知生成MnO4-,因此溶液由无色变为紫色,所以其特征现象是溶液由无色变为紫色。由于过二硫酸钾具有强氧化性,可以Cl-氧化为氯气,因此其他的生成物还有氯气。
(3)①反应中NaBiO3→Bi2(SO4)3,Bi元素化合价由+5价降低为+3价,得到2个电子,因此生成1mol Bi2(SO4)3得到4mol电子。MnSO4→NaMnO4,Mn元素化合价由+2价升高为+7价,失去5个电子。因此根据电子得失守恒可知,Bi2(SO4)3系数为5,MnSO4系数为4。根据原子守恒可知,NaBiO3的系数为10,NaMnO4系数为4。根据钠原子守恒可知Na2SO4的系数为3。根据硫酸根守恒可知H2SO4的系数为14。根据氢元素守恒可知H2O的系数为14,所以配平后的化学方程式为10NaBiO3+4MnSO4+14H2SO4=3Na2SO4+5Bi2(SO4)3+4NaMnO4+14H2O。其中标出电子转移的方向和数目为: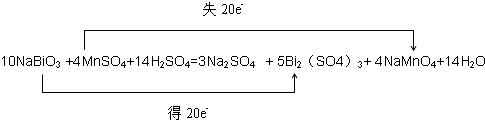
或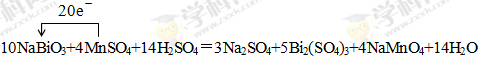 。
。
②反应中NaBiO3→Bi2(SO4)3,Bi元素化合价由+5价降低为+3价,得到电子,NaBiO3是氧化剂,所以Bi2(SO4)3是还原产物。
考点:考查萃取操作、氧化性强弱的判断、氧化还原反应的配平等


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:填空题
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)  MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 。
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室里迅速制备少量氯气可利用以下反应:
KMnO4+ HCl  KCl + MnCl2 + Cl2↑ + H2O
KCl + MnCl2 + Cl2↑ + H2O
(1)请配平上述化学方程式,并在上面用“双线桥法” 标明电子转移的方向和数目:
(2)该反应的氧化产物是 ,KMnO4发生 反应。
(3)HCl在上述反应中显示出来的性质是 。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
阅读下列材料后回答问题。
一个体重60 kg健康的成年人,体内约含有4 g铁,这4 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+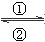 Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。
Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。
(2)“服用维生素C,可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应中作___________剂,具有___________性。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为_______________
(并用单线桥法标出该式中的电子转移方向和数目)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。
完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。请完成并配平上述反应:
____KI+____CuSO4 → ____I2+____Cu2I2↓+ ____________
该反应中氧化剂与还原剂的物质的量之比为___________。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。
写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是____________________。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:
2Cu2I2+Hg → Cu2HgI4(玫瑰红)+ 2Cu
产物Cu2HgI4中,Cu元素显____价。
当有1 molCu2I2参与反应时,转移电子____mol。
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作。试剂M和操作N的组合正确的是_____(选填编号)
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液 | 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
汽车尾气产生的NO2、CO等大气污染物,可以在催化剂的作用下转化为无毒物。其反应式可表示为:2NO2 +4CO=N2 +4CO2
①用双线法标出上述反应电子转移的方向和数目:
②该反应中氧化剂是 ,还原剂是 ,每有28g N2生成,反应中转移的电子为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
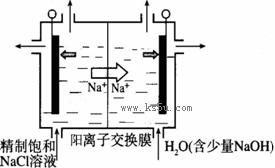
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
仔细阅读下列三段文字
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
②将0.08 mol KMnO4固体(质量为12.64 g)加热一段时间后,收集到a mol O2;向反应后残留的固体中加入足量的浓盐酸,又收集到b mol Cl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:Cl2+2e- =2Cl- 。
回答问题:
(1)试写出①有关的离子方程式:________________________________________________。
(2)请配平②的化学方程式:
____KMnO4+____HCl -______KCl+ _____MnCl2+_____Cl2↑+____ H2O
通过对第②段文字中提供的数据进行计算可得出:a +b的最大值为 ____ ,a +b最小值为_____。
(3)下列四种物质中能使③中的还原过程发生的物质是________。
| A.Na2CO3 | B.KMnO4 | C.XeO3 | D.Na2SO3 |

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
“低碳循环”引起世界各国的高度关注,而如何降低大气中CO2的含量及有效地开发利用CO2,更是引起了全世界的普遍重视。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请配平该反应的化学方程式:(将化学计量数按顺序填在答题卷上)
___C+____KMnO4+____H2SO4→___CO2↑+____MnSO4+____K2SO4+___H2O
(2)将不同最的CO(g)和H2O(g)分别通人到容积为2L的恒容密闭容器中,进行如下反应:
CO(g)+H2O(g) CO2(g)+H2(g) 得到表中三组数据
CO2(g)+H2(g) 得到表中三组数据
| 实验 | 温度℃ | 起始量/mol | 平均量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com