
【题目】某化学研究性学习小组设想探究铜的常见化学性质,过程设计如下:
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价的铜稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它能被氮的某种气态氢化物还原吗?
[实验探究]
Ⅰ.解决问题1:
(1)需用到的药品除铜、铝、1mol/LCuSO4溶液、稀H2SO4外还需___________ (填试剂化学式);
(2)配制1 mol/LCuSO4溶液25mL,选用的仪器除烧杯、天平、玻璃棒、量筒、胶头滴管外,还有_________________(填仪器名称);
(3)为达到目的,你认为应进行哪些相关实验?(实验内容和步骤)
①制备Cu(OH)2; ②_______________________________________________________
Ⅱ.解决问题2的实验步骤和现象如下:取一定量制得的氢氧化铜周体,于坩埚中灼烧,当温度达到80~100℃得到黑色同体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸或盐酸,得到蓝色溶液,同时观察到试管底还有红色固体存在。根据以上实验及现象:
(4)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:_________________________________;
(5)从实验Ⅱ可得出的结论是__________________________________________________________。
Ⅲ.解决问题3:
设计如下装置:(夹持装置未画出)
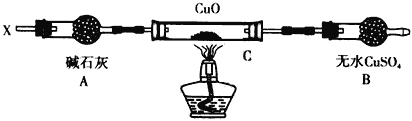
当某种氮的气态氢化物(X)缓缓通过灼热的氧化铜,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入红热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36 g,并收集到单质气体Y0.28 g;
(6)研究小组同学确证燃烧管生成的红色物质是铜,你认为他们确证的方法是________________;
(7)X气体的摩尔质量为_____________;
(8)C中发生反应的化学方程式:______________________________________________________。
【答案】NaOH溶液250 mL容器瓶将Cu(OH)2分别与稀硫酸、NaOH溶液反应Cu2O+2H+=Cu+Cu2++H2O固体时低温下,Cu2+稳定;1 000℃以上时,Cu+稳定;在酸性环境Cu2+稳定、Cu+不稳定将红色物质置于稀硫酸中,若溶液不变蓝,则确定为Cu32g/molN2H4+2CuO![]() 2Cu+N2+2H2O
2Cu+N2+2H2O
【解析】
Ⅰ、(1)探究氢氧化铜是否能和硫酸和氢氧化钠反应的实验来选择药品;(2)配制一定物质的量浓度的溶液所需仪器:烧杯、天平、玻璃棒、量筒、胶头滴管、一定体积的容量瓶;(3)氢氧化铜是否能和硫酸和氢氧化钠反应的实验中,首先是氢氧化铜的配制,然后是让氢氧化铜和硫酸以及氢氧化钠反应;Ⅱ、(4)氧化亚铜与稀硫酸(或盐酸)反应生成金属单质铜和二价铜离子的盐溶液;(5)根据溶液中的离子反应来确定稳定存在的离子;Ⅲ、(6)根据金属铜和氧化亚铜的性质区别来回答;(8)根据原子守恒确定气态氢化物的化学式,并根据实验现象来书写化学方程式。
Ⅰ、(1)探究氢氧化铜是否能和硫酸和氢氧化钠反应的实验需要的药品是:制取氢氧化铜的硫酸铜和氢氧化钠,验证试验用到硫酸和氢氧化钠,所以需要硫酸铜和氢氧化钠以及硫酸溶液;(2)配制一定物质的量浓度的溶液所需仪器:烧杯、天平、玻璃棒、量筒、胶头滴管、一定体积的容量瓶,容量瓶的规格根据所配置的溶液来确定,故答案为:250mL容量瓶;(3)氢氧化铜是否能和硫酸和氢氧化钠反应的实验中,首先是氢氧化铜的配制,然后是让氢氧化铜和硫酸以及氢氧化钠反应,所以实验步骤第一步是:用CuSO4溶液和NaOH溶液制Cu(OH)2;第二步是:将Cu(OH)2分别与稀H2SO4和NaOH溶液反应,故答案为:将Cu(OH)2分别与稀H2SO4和NaOH溶液反应;Ⅱ、(4)氧化亚铜与稀硫酸(或盐酸)反应生成金属单质铜和二价铜离子的盐溶液,反应实质是:Cu2O+2H+=Cu+Cu2++H2O;(5)根据溶液中的离子反应Cu2O+2H+=Cu+Cu2++H2O 可以知道在溶液中Cu2+的稳定性强于Cu+,故从实验Ⅱ可得出的结论是:固体时低温下,Cu2+稳定;1 000℃以上时,Cu+稳定;在酸性环境Cu2+稳定、Cu+不稳定;Ⅲ、(6)金属铜不能和稀硫酸反应,氧化亚铜能和稀硫酸反应,生成硫酸铜蓝色溶液,故答案为:将红色物质置于稀硫酸中,溶液不变蓝,则证明为铜;(7)消耗0.01mol X,测得B装置增重0.36g,即生成0.02mol的水,并收集到单质气体Y 0.28g即氮气0.01mol,根据原子守恒可以确定气态氢化物X中含有4个氢原子和2个氮原子,X的化学式为N2H4,摩尔质量为32g/mol;(8)C中发生反应是N2H4和氧化铜反应生成铜、氮气和水,反应的化学方程式为:N2H4+2CuO![]() 2Cu+N2+2H2O。
2Cu+N2+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如图所示。
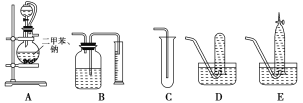
请回答以下问题:
(1)测量氢气体积的正确装置是________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)。
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是
________________________________________________________________________。
(4)已知无水酒精的密度为0.789 g·cm-3,移取2.0 mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为________,由此可确定乙醇的结构式为________________而不是____________________________________________________。
(5)实验所测定的结果偏高,可能引起的原因是________(填写编号)。
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠的反应不够完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是
A. 磁性氧化铁溶于稀硝酸:3Fe2++4H++ NO 3-![]() 3Fe3++NO↑+3H2O
3Fe3++NO↑+3H2O
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C. 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O![]() Al(OH)3↓+HCO3-
Al(OH)3↓+HCO3-
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3![]() 2FeO42-+3Cl-+H2O+4H+
2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中水既不做氧化剂,又不做还原剂的氧化还原反应是
A.CaO+H2O=Ca(OH)2B.Cl2+H2O=HCl+HClO
C.2Na+2H2O=2NaOH+H2↑D.C+H2O=CO+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的5种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;B原子的最外层电子数是次外层电子数的两倍; C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
(1)B在元素周期表中的位置是_____________________;
(2)E的离子结构示意图是_____;DA中含有_______;(填化学键类型)
(3)BC2的电子式为________;(用具体元素表示,下同)
(4)C、D、E三种元素简单离子的离子半径由大到小的顺序是______________________;
(5)C和E形成氢化物的稳定性关系是__________________;为证明E最高价氧化物对应水化物酸性强于B时发生的化学反应方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列化学用语:
(1)CH4和Cl2反应生成一氯甲烷的化学方程式: _________。反应类型是_________。
(2)乙烯使Br2/CCl4溶液褪色所发生反应方程式_________。反应类型是_________。
(3)乙醇与氧气反应生成乙醛的化学方程式_________。反应类型是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌合金的颜色酷似金的颜色,所以近来用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是( )
A. 测定密度 B. 放入硝酸中 C. 放入盐酸中 D. 观察外观
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中的应用广泛.下列叙述不正确的是( )
A. 硅单质可用来制造太阳能电池
B. 二氧化硅是制造光导纤维的材料
C. 石英(SiO2)可用来制作工艺品
D. 硅单质是制造玻璃的主要原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com