
【题目】下列反应中水既不做氧化剂,又不做还原剂的氧化还原反应是
A.CaO+H2O=Ca(OH)2B.Cl2+H2O=HCl+HClO
C.2Na+2H2O=2NaOH+H2↑D.C+H2O=CO+H2
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

(1)B极上的电极反应式为___________________________。
(2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,则电解时阳极的反应式为_______________________________________,当阳极收集到11.2L(标准状况)气体时,消耗甲醇的质量为__________克(保留两位有效数字),若要使溶液复原,可向电解后的溶液中加入的物质有 ___________。
(3)目前已开发出用电解法制取ClO2的新工艺。
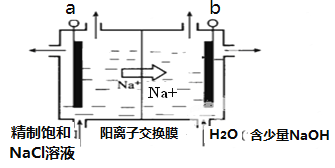
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的________极(填A或B),写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组实验探究KI和FeCl3生成KCl、I2和FeCl2的反应存在一定限度。
实验:i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液。充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
(1)将KI和FeCl3反应的离子方程式补充完整。_____I-+___Fe3+![]() ______I2+_______Fe2+
______I2+_______Fe2+
(2)步骤ⅲ中,试剂X是_____________。
(3)步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应:I2(g)+H2(g) ![]() 2HI(g)(正反应吸热)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中所列出的条件,其他条件不变,试将化学反应速率的改变(“增大”、“减小”或“不变”)填入相应的表格。
2HI(g)(正反应吸热)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中所列出的条件,其他条件不变,试将化学反应速率的改变(“增大”、“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
(1) | 降低温度 | ____________ |
(2) | 加入催化剂 | _____________ |
(3) | 再充入a mol H2 | _____________ |
(4) | 将容器容积扩大为原来2倍 | ___________ |
(5) | 通入b mol Ne(g) | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素X、Y、Z、W的原子序数依饮增大,X的原子半径是短周期主族元素原子中最小的,Z与Y、W均相邻,Y、Z和W三种元素的原子最外层电子数之和为17。下列说法正确的是
A. Y、Z和W三种元素可能位于同一周期
B. X、Y、Z三种元素可以组成共价化合物和离子化合物
C. 气态氢化物的热稳定性:Z<W
D. 氧化物对应的水化物的酸性:Y>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的优点是______________________________________________;调节pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
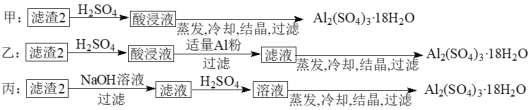
上述三种方案中,______方案不可行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组设想探究铜的常见化学性质,过程设计如下:
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价的铜稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它能被氮的某种气态氢化物还原吗?
[实验探究]
Ⅰ.解决问题1:
(1)需用到的药品除铜、铝、1mol/LCuSO4溶液、稀H2SO4外还需___________ (填试剂化学式);
(2)配制1 mol/LCuSO4溶液25mL,选用的仪器除烧杯、天平、玻璃棒、量筒、胶头滴管外,还有_________________(填仪器名称);
(3)为达到目的,你认为应进行哪些相关实验?(实验内容和步骤)
①制备Cu(OH)2; ②_______________________________________________________
Ⅱ.解决问题2的实验步骤和现象如下:取一定量制得的氢氧化铜周体,于坩埚中灼烧,当温度达到80~100℃得到黑色同体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸或盐酸,得到蓝色溶液,同时观察到试管底还有红色固体存在。根据以上实验及现象:
(4)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:_________________________________;
(5)从实验Ⅱ可得出的结论是__________________________________________________________。
Ⅲ.解决问题3:
设计如下装置:(夹持装置未画出)
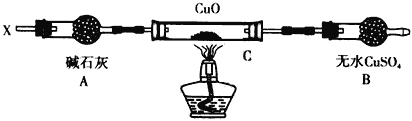
当某种氮的气态氢化物(X)缓缓通过灼热的氧化铜,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入红热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36 g,并收集到单质气体Y0.28 g;
(6)研究小组同学确证燃烧管生成的红色物质是铜,你认为他们确证的方法是________________;
(7)X气体的摩尔质量为_____________;
(8)C中发生反应的化学方程式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 饱和氯水中:Cl-、NO![]() 、Na+、SO
、Na+、SO![]()
B. Na2S溶液中:SO![]() 、K+、Cl-、Cu2+
、K+、Cl-、Cu2+
C. 由水电离出的c(OH-)=1×10-12 mol·L-1的溶液中:Ba2+、K+、NO![]() 、Cl-
、Cl-
D. 常温下pH=7溶液中:NO![]() 、I-、Na+、Al3+
、I-、Na+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞船可用肼(N2H4)作动力源。已知1 g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05 kJ热量,化学方程式为N2H4+2H2O2=N2↑+4H2O。下列说法中错误的是 ( )
A. 肼(N2H4)分子中只存在极性共价键
B. 此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ
C. 该反应中肼作还原剂
D. 该反应的反应物总能量高于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com