
2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于 Pt和
Pt和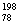 Pt的说法正确的是(
Pt的说法正确的是(  )
)
A.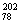 Pt和
Pt和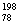 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B. Pt和
Pt和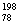 Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C. Pt和
Pt和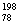 Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D. Pt和
Pt和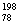 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
科目:高中化学 来源: 题型:
[化学—物质结构与性质]石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。
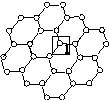
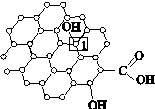
(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________。
(2)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
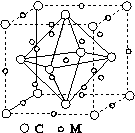
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中
A.75.77%表示35Cl的质量分数 B.24.23%表示35Cl的丰度
C.35. 453表示氯元素的相对原子质量 D.36.966表示37Cl的质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和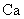 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)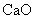 .
.
(1)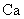 元素在周期表中位置是 ,其原子结构示意图 .
元素在周期表中位置是 ,其原子结构示意图 .
(2)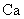 与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与
与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与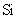 形成的化合物E的沸点 .
形成的化合物E的沸点 .
(3)配平用钙线氧脱鳞的化学方程式:
P+ FeO+ CaO
 + Fe
+ Fe
(4)将钙线试样溶于稀盐酸后,加入过量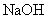 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色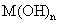 .则金属M为______;检测
.则金属M为______;检测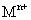 的方法是_____(用离子方程式表达).
的方法是_____(用离子方程式表达).
(5)取1.6g钙线试样,与水充分反映,生成224ml.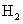 (标准状况),在想溶液中通入适量的
(标准状况),在想溶液中通入适量的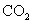 ,最多能得到
,最多能得到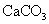 g.
g.
查看答案和解析>>
科目:高中化学 来源: 题型:
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式_________________________。
(2)根据等电子原理,写出CO分子的结构式______________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是_____________________;甲醛分子中碳原子轨道的杂化类型为_____________________。
②甲醛分子的空间构型是_____________________;1 mol甲醛分子中σ键的数目为_____________________。
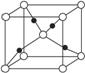
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________。
B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
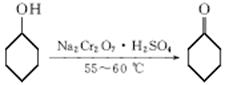
环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g·cm-3,20 ℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.962 4 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.947 8 | 微溶于水 |
| 水 | 100.0 | 0.998 2 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~60 ℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100 ℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为_____________________。
②蒸馏不能分离环己酮和水的原因是_____________________。
(2)环己酮 的提纯需要经过以下一系列的操作:a.蒸馏,收集151~156 ℃的馏分;b.过滤;c.在收集到的馏分中加NaCl固体至饱和,静置,分液;d.加入无水MgSO4固体,除去有机物中少量水。
的提纯需要经过以下一系列的操作:a.蒸馏,收集151~156 ℃的馏分;b.过滤;c.在收集到的馏分中加NaCl固体至饱和,静置,分液;d.加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是_______________________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需_______________。
③在上述操作c中,加入NaCl固体的作用是_______________________________________
_____________________________________________________________________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有______________种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是__________;X与氢元素形成的化合物的电子式是_____________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________ ________;D与E能形成一种非极性分子,该分子的结构式为________________;D所在族元素的氢化物中,沸点最低的是_________________________。
________;D与E能形成一种非极性分子,该分子的结构式为________________;D所在族元素的氢化物中,沸点最低的是_________________________。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是____________________________________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com