
[化学—物质结构与性质]石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。
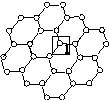
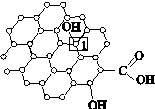
(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________。
(2)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
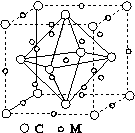
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
(1)3
(2)sp3 <
(3)O、H
(4)12 M3C60
[解析] (1)由图(a)可知,1号C与另外3个碳原子形成3个σ键。(2)图(b)中1号C与3个碳原子、1个氧原子共形成4个σ键,其价层电子对数为4,C的杂化方式为sp3;该C与相邻C的键角约为109°28′,图(a)中1号C采取sp2杂化,碳原子间夹角为120°。(3)氧化石墨烯中“—OH”的O可与H2O中的H形成氢键、氧化石墨烯中“—OH”的H可与H2O中的O形成氢键,氧化石墨烯中可与H2O形成氢键的原子有O、H。(4)利用“均摊法”可知该晶胞棱上12个M完全属于该晶胞的M为12×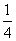 =3,位于晶胞内的9个M完全属于该晶胞,故该晶胞中M原子的个数为12;该晶胞中含有C60的个数为8×
=3,位于晶胞内的9个M完全属于该晶胞,故该晶胞中M原子的个数为12;该晶胞中含有C60的个数为8×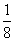 +6×
+6×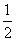 =4,因此该晶胞的化学式为M3C60。
=4,因此该晶胞的化学式为M3C60。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
使用数字化实验室(由电脑、数据采集器、专用传感器、数字化探头以及平常使用的化学仪器和试剂等组成)测得关于0.1mol/L的CH3COONa溶液的几组数据:室温时0.1mol/L的CH3COONa溶液的pH为8.75;在室温将其加水稀释到0.01mol/L, 其pH为8.27;若将0.1mol/L的CH3COONa溶液加热,加热过程中pH的变化如下图,
则下列说法错误的是:
A.以上实验数据都可以说明CH3COONa溶液中存在水解平衡
B.CH3COONa水解平衡常数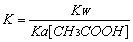
C.在室温将0.1mol/L CH3COONa溶液加水稀释到0.01mol/L,pH由8.75变化到8.27,可以说明0.1mol/LCH3COONa溶液水解程度更大
D.加热0.1mol/L的CH3COONa溶液,pH的变化可说明温度升高,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
对危险化学品要在包装标签上印上警示性标志。下列化学品名称与警示标志名称对应正确的是 ( )
A.酒精—剧毒品 B.浓硫酸—腐蚀品
C.氯化钠—易燃品 D.烧碱—剧毒品
查看答案和解析>>
科目:高中化学 来源: 题型:
已知3.02×1023个X气体分子的质量为16g,则X气体的摩尔质量是 ( )
A.16 g B.32 g /mol C.32 g D.64 g /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。


(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________。
(2)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。

(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
[选修3——物质结构与性质] Ⅰ.对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是( )
A.SiX4难水解
B.SiX4是共价化合物
C.NaX易水解
D.NaX的熔点一般高于SiX4
Ⅱ.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
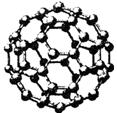
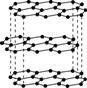
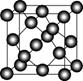
C60 石墨 金刚石晶胞
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为________________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在________共价键,还有________键。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=____________a,列式表示碳原子在晶胞中的空间占有率____________________(不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)可正确表示原子轨道的是________。
A.2s B.2d
C.3px D.3f
(2)写出基态镓(Ga)原子的电子排布式:________。
(3)下列物质变化,只与范德华力有关的是________ 。
A.干冰熔化 B.乙酸汽化
C.乙醇与丙酮混溶 D.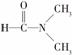 溶于水
溶于水
E.碘溶于四氯化碳 F.石英熔融
(4)下列物质中,只含有极性键的分子是________,既含离子键又含共价键的化合物是________;只存在σ键的分子是________,同时存在σ键和π键的分子是________。
A. N2 B.CO2 C.CH2Cl2 D.C2H4
E.C2H6 F.CaCl2 G.NH4Cl
(5)用“>”、“<”或“=”填空:
第一电离能的大小:Mg________Al;熔点的高低:KCl________ MgO。
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于 Pt和
Pt和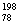 Pt的说法正确的是(
Pt的说法正确的是(  )
)
A.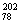 Pt和
Pt和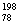 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B. Pt和
Pt和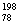 Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C. Pt和
Pt和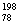 Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D. Pt和
Pt和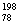 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com