
氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中
A.75.77%表示35Cl的质量分数 B.24.23%表示35Cl的丰度
C.35. 453表示氯元素的相对原子质量 D.36.966表示37Cl的质量数
 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
对危险化学品要在包装标签上印上警示性标志。下列化学品名称与警示标志名称对应正确的是 ( )
A.酒精—剧毒品 B.浓硫酸—腐蚀品
C.氯化钠—易燃品 D.烧碱—剧毒品
查看答案和解析>>
科目:高中化学 来源: 题型:
[选修3——物质结构与性质] Ⅰ.对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是( )
A.SiX4难水解
B.SiX4是共价化合物
C.NaX易水解
D.NaX的熔点一般高于SiX4
Ⅱ.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
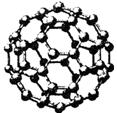
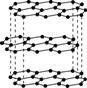
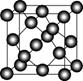
C60 石墨 金刚石晶胞
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为________________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在________共价键,还有________键。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=____________a,列式表示碳原子在晶胞中的空间占有率____________________(不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)可正确表示原子轨道的是________。
A.2s B.2d
C.3px D.3f
(2)写出基态镓(Ga)原子的电子排布式:________。
(3)下列物质变化,只与范德华力有关的是________ 。
A.干冰熔化 B.乙酸汽化
C.乙醇与丙酮混溶 D.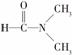 溶于水
溶于水
E.碘溶于四氯化碳 F.石英熔融
(4)下列物质中,只含有极性键的分子是________,既含离子键又含共价键的化合物是________;只存在σ键的分子是________,同时存在σ键和π键的分子是________。
A. N2 B.CO2 C.CH2Cl2 D.C2H4
E.C2H6 F.CaCl2 G.NH4Cl
(5)用“>”、“<”或“=”填空:
第一电离能的大小:Mg________Al;熔点的高低:KCl________ MgO。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
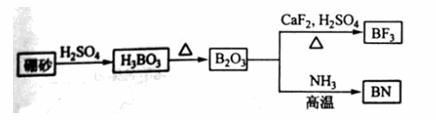
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.主族元素X、Y能形成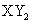 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于 Pt和
Pt和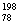 Pt的说法正确的是(
Pt的说法正确的是(  )
)
A.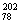 Pt和
Pt和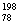 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B. Pt和
Pt和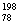 Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C. Pt和
Pt和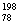 Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D. Pt和
Pt和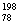 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
23.(A)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子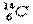 ,写出该微粒的电子式 (用元素符号表示)
,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a 常温下Z的单质和T的单质状态不同 b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是 。
(B)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图 。
写出元素Z的气态氢化物的电子式 (用元素符号表示)
(2)写出Y元素最高价氧化物的水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a 常温下氯气的颜色比T单质的颜色深
b T的单质通入氯化钠水溶液不能置换出氯气
c 氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 ,理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com