
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
【答案】C K2S和N2 +1 CuI 0.5 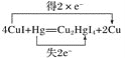 1 5 8 1 5 4 0.007
1 5 8 1 5 4 0.007
【解析】
(1)氧化还原反应反应中,氧化剂中元素的化合价降低,发生还原反应,对应产物为还原产物;还原剂中元素化合价升高,发生氧化反应,对应产物为氧化产物;据以上分析解答。
(2)反应4CuI+Hg=Cu2HgI4+2Cu中,铜元素的化合价由+1价降到0价,所以CuI做氧化剂;汞元素的化合价由0价升高到+2价,汞做还原剂;该反应共转移2e-电子,据此标出电子转移的方向和数目,并根据2e--4CuI关系进行计算;
(3)①根据氧化还原反应中电子守恒、电荷守恒、原子守恒进行配平;
②设与(NH4)2Fe(SO4)2反应消耗高锰酸钾xmol,根据反应MnO4-+5Fe2++8H+===Mn2++5Fe3++4H2O列方程进行计算。
(1)本反应中,氮元素的化合价由+5价变为0价,硫元素的化合价由0价变为-2价,碳元素的化合价由0价变为+4价,被氧化的元素是C。氧化剂是KNO3和S,氧化产物是CO2,还原产物是K2S和N2。
综上所述,本题答案是:C,K2S和N2。
(2)①I元素的负价只有-1价,Cu在化合物中只有+1、+2价,再由化学式中各元素正负化合价代数和等于零确定各元素的化合价,由此可确定Cu2HgI4中Cu为+1价,Hg为+2价。
综上所述,本题答案是:+1。
②反应4CuI+Hg===Cu2HgI4+2Cu中,铜元素由+1价降到0价,发生还原反应,所以氧化剂为CuI;每4mol CuI参加反应转移电子2 mol,即当有1molCuI参加反应时,转移电子0.5 mol。
综上所述,本题答案是:CuI,0.5。
③反应4CuI+Hg===Cu2HgI4+2Cu中,1molHg参加反应转移电子2mol,所以该反应电子转移的方向和数目如下: ;
;
综上所述,本题答案是: 。
。
(3)①反应中Mn元素的化合价由+7降低到+2,Fe元素的化合价由+2升高到+3,由电子守恒、电荷守恒、原子守恒可知,离子反应为MnO4-+5Fe2++8H+===Mn2++5Fe3++4H2O。
综上所述,本题答案是:1 5 8 1 5 4。
②设与(NH4)2Fe(SO4)2反应消耗高锰酸钾xmol,则
MnO4-+5Fe2++8H+===Mn2++5Fe3++4H2O
1mol 5mol
xmol 0.350L×0.1mol·L-1
所以x=0.007,即与固体混合物反应后剩余KMnO4的物质的量为0.007 mol。
综上所述,本题答案是:0.007。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
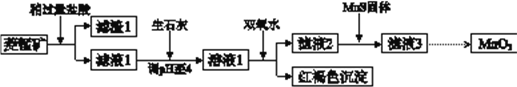
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________。盐酸溶解MnCO3的化学方程式是_________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。用酸化的NaClO3溶液将MnCl2氧化生成MnO2和Cl2,该反应的离子方程式为___________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是___________。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_________。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Ca2+、MnO4-、Cl-
C.Ba2+、Na+、AlO2-、NO3- D.NH4+、Fe3+、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中常含有少量的泥沙及氯化钙、氯化镁、硫酸盐等一些可溶性的杂质。粗盐的提纯实验操作步骤如下图所示:
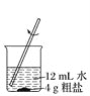

① ② ③
(1)请写出图中各步实验操作的名称①________,②________,③________。
(2)实验操作②的主要目的是____________________。
(3)实验操作③的目的是________________________。
(4)实验操作①②③中都使用的仪器是________,它在③中其作用是____________________。
(5)通过上述实验操作,得到的精盐中可能含有的杂质是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁与水蒸气的实验,并研究铁及其化合物的部分性质。
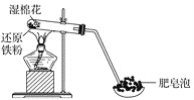
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______________________。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有____,可能有____;若溶液未变红色,则说明硬质试管中固体物质的成分是____________________。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是___________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按下图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:______________________________。
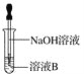
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有____________性。由此可知,实验室中含有Fe2+的盐溶液需现用现配制的原因是____________________,并且配制含Fe2+的盐溶液时应加入少量____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,2.24LSO3分子数为0.1NA
C. 40 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L
D. 0.1molNa2O2与足量潮湿的二氧化碳反应转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组按如图所示实验流程比较浓硝酸和稀硝酸的氧化性强弱,其中B为一种紫红色金属,C为红棕色气体。
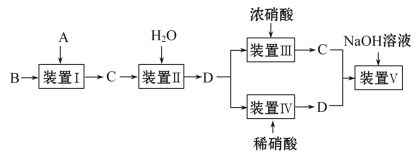
请回答下列问题:
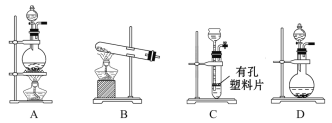
(1)A与B反应的化学方程式是___________________________________;A与B反应迅速,实验中需要采取措施控制气体放出的快慢及多少,则装置Ⅰ可以选择的装置为________。
(2)实验时在装置Ⅰ中加入B后,在加入A之前需向整套装置中通入足量的CO2气体,该操作的目的是______。
(3)装置Ⅱ中发生反应的化学方程式是_________________________。
(4)通过实验可得出:浓硝酸的氧化性比稀硝酸______(填“强”或“弱”),判断的依据是_________。
(5)小组内有同学指出该流程中装置Ⅴ可有可无,你认为装置Ⅴ是否需要___ (填“是”或“否”),理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O
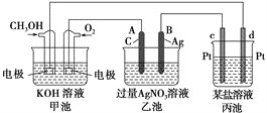
请回答:
(1)甲池是________池,通入O2的电极作为________极,电极反应式为__________。
(2)乙池是________池,A电极名称为________极,电极反应式为_______________。乙池中的总反应离子方程式为_____________________________________________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素位于周期表中第四周期ⅤA族,则该元素的名称和价电子排布式均正确的是( )
A. 砷,4s24p3B. 溴,4s24p5C. 磷,4s24p3D. 锑,5s25p3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com