
【题目】ClO2与Cl2的氧化性相近.在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过题图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究. 
(1)仪器C的名称是 . 安装F中导管时,应选用图2中的 .
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.该反应中氧化剂与还原剂物质的量之比为 , 为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜(填“快”或“慢”).
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2 , 此时F中溶液的颜色不变,则装置C的作用是 .
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 , 该反应的离子方程式为 , 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如题9图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是 , 原因是 .
【答案】
(1)干燥管;b
(2)1:1;慢
(3)吸收Cl2
(4)4H++5ClO2﹣=Cl﹣+4ClO2↑+2H2O;验证是否有ClO2 生成
(5)稳定剂Ⅱ;稳定剂Ⅱ可以缓慢释放ClO2 , 能较长时间维持保鲜所需的浓度
【解析】 解:(1)仪器C具有球形特征,据此可知该仪器是干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,故选b,所以答案是:干燥管;b;(2)在氧化还原反应中,反应物中元素化合价降低的物质为氧化剂,化合价升高的物质为还原剂,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O反应中,NaClO3中氯元素化合价由+5价降低为+4价,NaClO3是氧化剂,还原产物是ClO2;HCl中氯元素化合价由﹣1价升高为0价,HCl是还原剂,氧化产物是Cl2 , 根据氧化产物是Cl2 , 可知起还原剂与酸性的氯化氢各占一半,所以该反应中氧化剂与还原剂物质的量之比为1:1,为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,所以答案是:1:1;慢;(3)氯气有毒,能够与碘化钾反应,被碘化钾溶液吸收,所以F的作用为吸收Cl2 , 所以答案是:吸收Cl2;(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 , 根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2﹣=Cl﹣+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,所以答案是:4H++5ClO2﹣=Cl﹣+4ClO2↑+2H2O;验证是否有ClO2 生成;(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2 , 能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,所以答案是:稳定剂Ⅱ;稳定剂Ⅱ可以缓慢释放ClO2 , 能较长时间维持保鲜所需的浓度.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】如下图是一种验证某气体化学性质的实验装置,图中 B 为开关。如先打开 B,在A处通入干燥氯气,C 处红色布条颜色无变化;当关闭B,继续通入Cl2 时,C处红色布条颜色褪去。则 D 瓶中盛有的溶液是( )

A. 饱和 NaCl 溶液
B. 浓 H2SO4
C. NaOH 溶液
D. Ca (OH) 2 悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.青铜是我国使用最早的合金B.普通钢是纯净物,不锈钢是混合物
C.钢化玻璃是掺入了钢铁的玻璃,因此不易破裂D.光导纤维是以石油为原料生成的合成材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100mL稀硝酸中完全溶解,反应过程中无气体放出。向反应后的溶液中,逐滴加入1.00 mol/L NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量关系如图所示,则下列说法错误的是

A. 合金中镁铝的物质的量之比为1:2
B. 合金完全溶解转移电子的物质的量为0. 032mol
C. 原稀硝酸的物质的量浓度为0. 45 mol/L
D. F点溶液中,溶质仅为Na[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可行的是
A. 加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质
B. 用NaOH溶液除去CO2中混有的HCl气体
C. 将水加入到浓硫酸里进行稀释
D. 用乙醇从碘水中萃取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锆是重要的耐高温材料、陶瓷绝缘材料.以锆英砂(主要成分为ZrSiO4 , 还含有少量Fe2O3、Al2O3、SiO2等杂货)为原料制备二氧化锆(ZrO2)的工艺流程如图所示.  已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表
离子 | Fe3+ | AP+ | ZrO2+ |
开始沉淀pH | 1.9 | 3.3 | 6.2 |
完仝沉淀pH | 3.2 | 5.2 | 8.0 |
(1)经熔融后,锆英砂中Zr元素以(写化学式)形式存在,写出酸浸时生成Al3+、Fe3+的离子方程式:
(2)滤渣I的主要成分的名称为
(3)向过滤Ⅰ所得溶液中加氨水调pH=a,其目的是然后继续加氨水至pH=b的范围是
(4)向过滤Ⅲ所得溶液中加入CaCO2粉末并加热,可得CO2和另一种气体,该反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
(1)添加Cu2O的涂料或玻璃显色.
(2)制备氧化亚铜的方法之一是用铜作阳极电解NaCl和NaOH混合溶液,其原理如图所示: 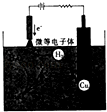
①阴极的电极反应式为 .
②溶液中CuCln1﹣n转化为Cu2O的离子方程式为
(3)工业生产中常采用高温煅烧氧化铜粉末制备Cu2O,但所得产品中会含有一定量CuO,测定产品中Cu2O的含量常用滴定法,其原理为: 样品溶解:Cu2O+Fe2(SO4)3+H2SO4═2FeSO4+2CuSO4+H2O.
滴定(未配平):□FeSO4+□KMnO4+□H2SO4═□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
①配平滴定反应的化学方程式.
②滴定时,KMnO4溶液盛放在(填“酸式”或“碱式”)滴定管中.
③若产品质量为1.0g,滴定时消耗0.10molL﹣1的KMnO4标准溶液20.00mL,则产品中Cu2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下一定能大量共存的是( )
A.在碱性溶液中:CO32﹣、K+、S2﹣、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3﹣、Mg2+、Na+、SO42﹣
C.在 ![]() ?=1×1012的溶液中:NH4+、AlO2﹣、C1﹣、K+
?=1×1012的溶液中:NH4+、AlO2﹣、C1﹣、K+
D.在中性溶液中:Fe3+、C1﹣、NO3﹣、A13+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O; ②2SO2+SeO2+2H2O===Se+2 SO42-+4H+。
(1)Se与浓H2SO4的反应中,氧化剂是__________,还原剂是___________,反应中被还原的元素是________。当有标准状况下22.4 L SO2气体生成时,转移电子的物质的量是________ mol。
(2)依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是______________________________________________________________________。
(3)用双线桥法标出反应②电子转移的方向和数目:_____________________________________。
(4)SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O
配平上述反应的化学方程式。________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com