
【题目】下列液体中,不会出现丁达尔现象的分散系是( )
①鸡蛋清溶液 ②水 ③淀粉溶液 ④蔗糖溶液 ⑤Fe(OH)3溶液 ⑥肥皂水
A.②④B.③④C.②④⑤D.④⑤
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以锌片和铜片为电极,以稀硫酸为电解质溶液的原电池中,当导线中通过2mol电子时,下列说法正确的是( )
A.锌片溶解了1mol,铜片上析出1mol氢气
B.锌片发生还原反应
C.正极附近的SO42﹣离子浓度逐渐增大
D.电池工作时,电子由正极通过外电路流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
(1)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(2)I2(s)+H2(g)![]() 2HI(g) ΔH="+26.48" kJ·mol-1
2HI(g) ΔH="+26.48" kJ·mol-1
下列判断正确的是( )
A. 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(1)的产物比反应(2)的产物稳定
D. 反应(2)的反应物的总能量比反应(1)的反应物的总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应:![]()
![]() 2SO3(g)。下列说法不正确的是
2SO3(g)。下列说法不正确的是
A. 改变反应条件可以改变该反应的限度
B. 达到平衡后,SO3、SO2、O2在密闭容器中共存
C. 达到平衡后,反应停止,正、逆反应速率都等于零
D. SO3、SO2、O2的浓度保持不变,说明该可逆反应达到了限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
(1)在元素①~⑧中,金属性最强的元素是_____________(填元素符号),最不容易形成化合物的元素是______________(填元素符号)。
(2)用电子式表示⑦的气态氢化物的形成过程________________________。
(3)③、④、⑥中原子半径由大到小的顺序是____________________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下:
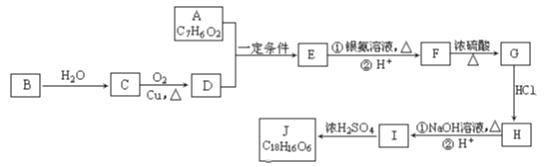
已知:①有关A的信息如下:
能发生银镜反应 |
与FeCl3溶液发生显色反应 |
核磁共振氢谱显示有4组峰,峰面积之比为1∶2∶2∶1 |
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平。
③![]()
回答以下问题:
(1)A中含有的含氧官能团名称是____和____。
(2)B→C的反应条件是:____。
(3)写出反应类型: G→H:_______、I→J:___。
(4)写出F生成G的化学方程式_______。
(5)写出J的结构简式 _____。
(6)结合题给信息,以D为原料经过三步反应制备1,3-丁二烯,设计合成路线(其他试剂任选)。
合成路线流程图示例:___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义。将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(1)。
CH3OCH3(g)+3H2O(1)。
(1)已知一定压强下,该反应在温度升高时,CH3OCH3(g)的浓度减小,则反应的焓变△H_____0,熵变△S_______0(分别填“>”、“<”、或“=”)。
(2)相同条件下,在体积为2L的密闭容器内选用不同的催化剂,生成物二甲醚CH3OCH3的量随时间变化如图所示。

①图中0-4min内A的反应速率v(CO2)=________。该温度下平衡常数的表达式为________。
②下列有关说法正确的是______(填字母序号)。
A.反应的活化能大小顺序是:Ea(A)<Ea(B)< Ea(C)
B.升高温度能使反应速率加快,是因为活化分子百分数增大
C.单位时间内消耗CO2与生成H2的数目为3:1时,说明反应已经达到平衡
D.增大压强,平衡正向移动,平衡常数K值增大
(3)某温度下,在体积可变的密闭容器中,改变起始时各物质的起始投料量,在不同的压强下,平衡时生成物二甲醚CH3OCH3(g)的物质的量如下表所示:
序号 | 起始投料量不同的压强下, 平衡CH3OCH3(g)的量不同的压强 | P1 | P2 | P3 |
I | 2.0 molCO2 6.0molH2 | 0.10mol | 0.04 mol | 0.02mol |
II | 1.0molCO2 3.0molH2 | X1 | Y1 | Z1 |
III | 1.0mol CH3OCH3 3.0mol H2O | X2 | Y2 | Z2 |
①P1___P2(填“ >”、“<”或“=”);判断理由为____________。
②X1=______________。
③P2下,III中CH3OCH3的平衡转化率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com