
【题目】南京工业大学某研究团队最近在《Nature Communications》刊文介绍了他们开发的一种新型催化剂——反钙钛矿基非贵金属催化剂,这种价廉的新型催化剂结合了钙钛矿结构的灵活性和过渡金属氮(碳)化合物的高导电性、优异电催化性等优点,理论上来说是一种很有发展潜力的析氧反应电催化剂。回答下列问题:
(1)基态氮原子核外未成对电子数为________,基态碳原子核外电子云有_______个伸展方向。
(2)在周期表中,N、O、F是位于同周期且相邻的三种元素,第一电离能最大的元素和最小的元素组成一种只含极性键的化合物M,M分子的立体构型是_________,中心原子的杂化类型是________。
(3)在周期表中,钡位于第六周期ⅡA族,钛酸钡、钛酸钙的熔点分别为1625℃、1975℃,二者熔点差异的原因为__。
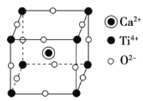
(4)钛酸钙的晶胞如图所示,钛酸钙的化学式为_____________;1个钛离子与________个氧离子等距离且最近,这些氧离子可构成正八面体,钛离子位于该正八面体的体心。已知钛酸钙的晶胞参数为a nm,则该正八面体的边长为________pm。
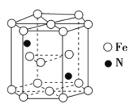
(5)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示,六棱柱底边边长为x cm,高为y cm,NA为阿伏加德罗常数的值,则晶胞的密度为________________g·cm-3(列出计算式即可)。
【答案】3 3 V形 sp3 同为离子晶体,Ca2+的半径小于Ba2+,CaTiO3的晶格能大于BaTiO3 CaTiO3 6 500![]() a
a 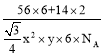
【解析】
(1)基态氮原子的核外电子排布式为1s22s22p3,基态C原子的核外电子排布式为1s22s22p2,由电子排布式分析可得;
(2)第一电离能的大小顺序为F>N>O,则M为只含极性键的OF2,由价层电子对数和孤对电子对数确定原子杂化方式和分子空间构型;
(3)两种晶体都是离子晶体,从离子半径角度分析,比较晶格能的大小;
(4)由分摊法计算钛酸钙的化学式,1个钛离子周围有6个氧离子与其等距离且最近,正八面体边长等于晶胞边长的![]() 倍;
倍;
(5) 由分摊法计算可得。
(1)基态N原子的核外电子排布式为1s22s22p3,s能级有1个轨道,1s、2s电子为成对电子,2p能级有3个轨道,3个电子各占据1个轨道,是未成对电子,则未成对电子数为3个;基态C原子的核外电子排布式为1s22s22p2,s能级上电子云只有1个伸展方向,2p能级上只填充2个电子,有2个伸展方向,共有3个伸展方向,故答案为:3;3;
(2)同一周期元素的第一电离能随着原子序数增大而增大,氮N元素的2p轨道电子处于半充满状态,稳定性较强,则第一电离能大小的顺序为F>N>O,第一电离能最大的F元素和最小的O元素组成一种只含极性键的化合物M的分子式为OF2,OF2分子中O原子的价层电子对数为4,孤对电子对数为2,则O原子的杂化方式为sp3杂化,分子的空间构型为V形,故答案为:V形;sp3;
(3)离子晶体具有较高的熔点,离子晶体的晶格能越大,熔点越高,由熔点可知,钛酸钡、钛酸钙均为离子晶体,Ca2+的半径小于Ba2+,CaTiO3的晶格能大于BaTiO3,则钛酸钡的熔点小于钛酸钙,故答案为:同为离子晶体,Ca2+的半径小于Ba2+,CaTiO3的晶格能大于BaTiO3;
(4)由晶胞结构可知,晶胞中钙离子的个数为1,钛离子的个数为8×![]() =1,氧离子个数为12×
=1,氧离子个数为12×![]() =3,离子个数比为1:1:3,则钛酸钙的化学式为CaTiO3;1个钛离子周围有6个氧离子与其等距离且最近,正八面体边长等于晶胞边长的
=3,离子个数比为1:1:3,则钛酸钙的化学式为CaTiO3;1个钛离子周围有6个氧离子与其等距离且最近,正八面体边长等于晶胞边长的![]() 倍,1 nm=103 pm,则该正八面体的边长为
倍,1 nm=103 pm,则该正八面体的边长为![]() ×103 pm=500
×103 pm=500![]() a pm,故答案为:CaTiO3;6;500
a pm,故答案为:CaTiO3;6;500![]() a;
a;
(5)由晶胞结构可知,晶胞含有12×![]() +2×
+2×![]() +3=6个Fe原子,含有2个N原子,六棱柱的底面由6个正三角形构成,正三角形的高为
+3=6个Fe原子,含有2个N原子,六棱柱的底面由6个正三角形构成,正三角形的高为![]() x cm,每个正三角形的面积为
x cm,每个正三角形的面积为![]() x2 cm2,晶胞的体积为
x2 cm2,晶胞的体积为![]() cm3,则晶胞的密度为
cm3,则晶胞的密度为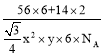 g/ cm3,故答案为:
g/ cm3,故答案为: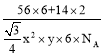 。
。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),请回答:
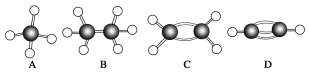
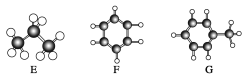
(1)常温下含碳量最高的液态烃是__________(填字母)。
(2)能使酸性KMnO4褪色的有______种(填数字)。
(3)一卤代物种类最多的是________(填字母)。
(4)写出实验室制取D的化学方程式_________。
(5)写出G与浓硝酸反应生成烈性炸药的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想通过测定反应过程中所放出的热量来计算中和热。他将50 mL0.5 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
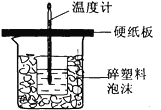
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是____。
(2)实验中改用20 mL0.50 mol/L的盐酸跟20 mL0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”);所求中和热的数值会___(填“相等”“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图像的描述正确的是
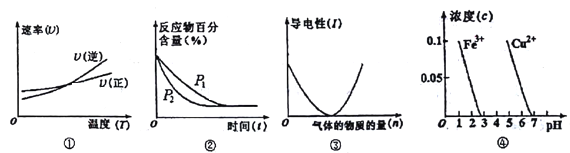
A. 根据图①判断反应A2(g)+3B2(g) ![]() 2AB3(g)的 △H>0
2AB3(g)的 △H>0
B. 图②可表示压强(P)对反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
C. 图③可表示向醋酸溶液通入氨气时,溶液导电性随氨气量的变化
D. 根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论一定错误的是( )
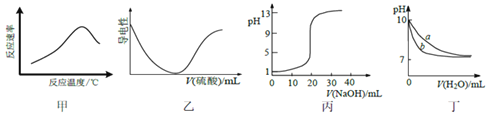
A.图甲表示酶催化反应的反应速率随反应温度的变化
B.图乙表示向![]() 溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
C.图丙表示用![]()
![]() NaOH溶液滴定
NaOH溶液滴定![]() mL
mL![]()
![]() 醋酸的滴定曲线
醋酸的滴定曲线
D.图丁表示相同温度下,向等体积![]() 的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.依据丁达尔现象可将分散系分为溶液、胶体与浊液
B.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
C.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
D.实验室从海带提取单质碘的方法是:取样![]() 灼烧
灼烧![]() 溶解
溶解![]() 过滤
过滤![]() 萃取
萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应: A(g)+xB(g)![]() 2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A. 平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B. x值等于3
C. A的转化率为20%
D. B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮氧化物等物质,造成严重的环境污染。煤的干馏是提高煤的利用率、生产重要化工原料、绣像污染物排放量的有效措施之一。某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如图所示,请回答有关问题:

(1)煤干馏的条件是___。
(2)盛有冷水的烧杯的作用是___。
(3)实验后检验有粗氨水生成的操作是___。
(4)已知CO不能使溴水退色,若将从具支试管支管口处逸出的气体通入溴水中,发现溴水退色,则说明煤的干馏产生了___。
(5)从煤焦油中分离出苯、甲苯、二甲苯的实验方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中准备有以下主要仪器及用品,大试管、带导管的单孔塞、药匙、镊子、水槽、集气瓶、玻璃片、酒精灯、铁架台,如果药品选用合理,用以上仪器用品,能完成的实验有( )
A.制取一氧化氮B.制取乙烯
C.制取乙炔D.氢气还原氧化铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com