
【题目】乙醇能发生如下反应:
①![]() ;
;
②![]() ,
,![]() 。
。
由以上反应得出的结论错误的是( )
A.由反应①②可知,条件不同,乙醇与![]() 反应的产物不同
反应的产物不同
B.由反应②可知,![]() 是乙醇氧化生成乙醛的催化剂
是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键、碳氧键 、氢氧键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
【答案】D
【解析】
A、根据反应乙醇在氧气中燃烧生成CO2和H2O,在铜作催化剂的条件下生成CH3CHO和H2O;
B、根据催化剂能参与反应,但前后质量不变;
C、根据乙醇燃烧时,所有的化学键均断裂;
D、根据反应的原理分析。
A、由反应①可知,乙醇在氧气中燃烧生成CO2和H2O;反应②可知乙醇与O在铜作催化剂的条件下生成CH3CHO和H2O,产物不同,故A正确;
B、根由反应②可知,Cu能参与反应,但前后质量不变,是催化剂,故B正确;
C、由反应①可知,乙醇燃烧时,所有的化学键均断裂,碳碳键、碳氢键、氢氧键均断裂,故C正确;
D、由反应②可知,乙醇氧化为乙醛时,断开了氢氧键、碳氢键,故D错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】密闭容器中,反应aA(g)+bB(g)![]() cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
A. a+b<c+d
B. 平衡向正反应方向移动
C. D的体积分数减小
D. 达到新平衡时,A、B的浓度减小,C、D浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂![]() 主要成分为
主要成分为 ![]() ,某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
,某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
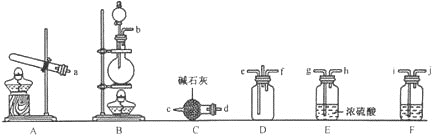
(1)岩脑砂的制备
![]() 利用装置A制取实验所需的氨气,写出反应的化学方程式:_____________。
利用装置A制取实验所需的氨气,写出反应的化学方程式:_____________。
![]() 该实验中用浓盐酸与
该实验中用浓盐酸与![]() 反应制取所需氯气,则装罝F中的试剂是
反应制取所需氯气,则装罝F中的试剂是![]() 填写试剂名称
填写试剂名称![]() ___________________。
___________________。
![]() 为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:
为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:![]() _____
_____![]() ________
________![]() 提示:氨气和氯气形成逆向流动,更有利于二者充分混合
提示:氨气和氯气形成逆向流动,更有利于二者充分混合![]()
![]() 证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀
证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀![]() 、NaOH溶液外,还需要____________________。
、NaOH溶液外,还需要____________________。
(2)岩脑砂中元素的测定
准确称取![]() 岩脑砂,与足量的氧化铜混合加热
岩脑砂,与足量的氧化铜混合加热![]() 发生的反应为
发生的反应为![]() ,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
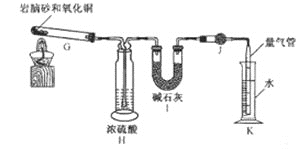
![]() 设置装置H的目的是____________________。
设置装置H的目的是____________________。
![]() 若装置Ⅰ增重
若装置Ⅰ增重 ![]() ,利用装置 K测得气体体积为
,利用装置 K测得气体体积为 ![]() 已知常温常压下气体摩尔体积为
已知常温常压下气体摩尔体积为 ![]() ,则岩脑砂中
,则岩脑砂中 ![]() _____________
_____________![]() 用含 b、V的代数式表示,不必化简
用含 b、V的代数式表示,不必化简![]() 。若测量体积时气体温度高于常温
。若测量体积时气体温度高于常温![]() 其他操作均正确
其他操作均正确![]() ,则
,则 ![]() 比正常值______________
比正常值______________![]() 填“偏高”“偏低”或“无影响”
填“偏高”“偏低”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢![]() 是一种有大蒜气味的、无色剧毒的强还原性气体,易在空气中自燃,一般在稀释状态下使用能降低风险。某科研小组拟用水解法制备并冷凝收集部分干燥的
是一种有大蒜气味的、无色剧毒的强还原性气体,易在空气中自燃,一般在稀释状态下使用能降低风险。某科研小组拟用水解法制备并冷凝收集部分干燥的![]() ,再利用未液化的余气继续探究其热分解情况。实验装置图及编号如下
,再利用未液化的余气继续探究其热分解情况。实验装置图及编号如下![]() 导管和部分夹持装置省略
导管和部分夹持装置省略![]() ,其中装置D是鼓泡器,用于监测
,其中装置D是鼓泡器,用于监测![]() 的流速。
的流速。
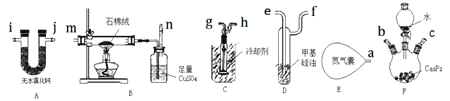
(1)写出![]() 水解法制备
水解法制备![]() 的化学反应方程式________。由于
的化学反应方程式________。由于![]() 水解反应太剧烈,为了减缓反应速率实验室可用________代替水。
水解反应太剧烈,为了减缓反应速率实验室可用________代替水。
(2)实验装置接口的正确连接顺序为![]() ________
________![]() 。
。
(3)![]() 中盛装石棉绒的仪器名称是________;装置E中装有足量的
中盛装石棉绒的仪器名称是________;装置E中装有足量的![]() ,实验中需持续通入后续装置,其作用主要有________
,实验中需持续通入后续装置,其作用主要有________![]() 答两点即可
答两点即可![]() 。
。
(4)![]() 中反应一段时间后,出现白色蜡状固体,经检验为白磷
中反应一段时间后,出现白色蜡状固体,经检验为白磷![]() 。写出该反应的化学方程式________。
。写出该反应的化学方程式________。
(5)在![]() 溶液吸收未反应的
溶液吸收未反应的![]() 气体过程中,产生
气体过程中,产生![]() 和两种常见的最高价含氧酸,反应化学方程式为________;已知
和两种常见的最高价含氧酸,反应化学方程式为________;已知![]() 足量时,
足量时,![]() 可继续被还原生成Cu单质。该小组为了测定此次制备
可继续被还原生成Cu单质。该小组为了测定此次制备![]() 的体积分数,收集到A装置出口的气体体积为
的体积分数,收集到A装置出口的气体体积为![]() 已折算为标准状况
已折算为标准状况![]() ,刚好被
,刚好被![]() 的
的![]() 溶液完全吸收,经过滤、洗涤、干燥后,得到
溶液完全吸收,经过滤、洗涤、干燥后,得到![]() 单质,则
单质,则![]() 的体积分数为________。
的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为某机物与对应试剂的反应现象或是否反应,则这种有机物可能是( )
试剂 | 钠 | 溴的四氯化碳溶液 | 新制 | 乙酸 |
现象或是否反应 | 放出气体 | 褪色 | 逐渐溶解 | 不反应 |
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室用下图所示装置制备高浓度的次氯酸,先在Ⅱ中生成![]() ,再在Ⅲ中得到HClO溶液。
,再在Ⅲ中得到HClO溶液。
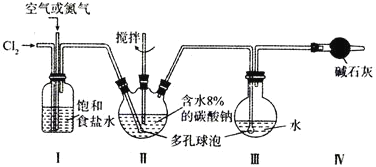
已知:![]() 的沸点为
的沸点为![]() ,
,![]() 以上分解为
以上分解为![]() 和
和![]() ;
;![]() 极易溶于水并与水反应生成HClO。
极易溶于水并与水反应生成HClO。
(1)反应中通入空气或氮气的作用是________________,实验中控制氯气与空气或氮气的体积比的方法是_________。
(2)装置Ⅱ、Ⅲ中使用多孔球泡的作用是_________;装置Ⅱ中发生反应的化学方程式为_________。
(3)反应时,Ⅱ中要加装冷却装置,其原因是__________。
(4)已知次氯酸可被![]() 还原成
还原成![]() ,可利用此原理测定Ⅲ中所得次氯酸溶液的物质的量浓度。
,可利用此原理测定Ⅲ中所得次氯酸溶液的物质的量浓度。
![]() 此反应的化学方程式为__________________________。
此反应的化学方程式为__________________________。
![]() 量取
量取![]() 次氯酸溶液于烧杯中,加入足量的
次氯酸溶液于烧杯中,加入足量的![]() 溶液,混合均匀后再加入足量的
溶液,混合均匀后再加入足量的![]() 溶液,反应完全后过滤,洗涤,干燥,用电子天平称量,得到固体
溶液,反应完全后过滤,洗涤,干燥,用电子天平称量,得到固体![]() ,则所制取次氯酸的浓度为______
,则所制取次氯酸的浓度为______![]() 。
。
(5)若制得上述次氯酸溶液![]() ,转化过程中氯的损耗为
,转化过程中氯的损耗为![]() ,则至少需要标况下
,则至少需要标况下![]() __________L。
__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是生产印刷颜料酞菁蓝的重要原料,工业上可用一种低品位铜矿(主要成分CuS、Cu2S、CuO、Fe2O3、FeO及其他非酸溶性杂质)和软锰矿(主要成分为MnO2和其他非酸溶性杂质)来进行生产,过程如下:

回答下列问题:
(1)步骤Ⅰ中反应较多,下列反应是其中之一:Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+4H2O+S,该反应的氧化产物为____________________(填化学式)。
(2)为确定滤液1中是否含有Fe2+,首先用有机萃取剂除去溶液中MnSO4,再取下层水溶液进行检测,所用试剂为_____________________。
(3)步骤Ⅱ加入氨水控制溶液的pH为5左右,目的是______________________。
(4)为模拟步骤Ⅲ的生产过程,某同学设计如下实验,下列有关叙述正确的是_____________。

A.a通入CO2,然后b通入NH3;c中放碱石灰
B.b通入NH3,然后a通入CO2;c中放碱石灰
C.a通入NH3,然后b通入CO2;c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3;c中放蘸稀硫酸|的脱脂棉
(5)步骤Ⅳ的滤液中主要成分X是步骤Ⅱ和步骤Ⅲ都有的产物,可以回收作为肥料使用,该肥料_______(填“可以”或“不可以”)与草木灰(有效成分K2CO3)共用,简述原因:__________。
(6)已知CuCl为难溶于水的白色沉淀,写出步骤Ⅴ发生反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知正四面体形分子E与线形分子G反应,生成四面体形分子L和直线形分子M。组成E分子中的元素的原子序数都小于10,组成G分子的元素为第三周期的元素。反应过程示意图如下,则下列判断中正确的是( )。
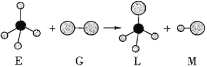
A.常温常压下,E是一种液态有机物B.M是一种含有非极性键的分子
C.干燥的G能漂白湿润的有色物质D.上述反应的类型是加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com