
【题目】已知正四面体形分子E与线形分子G反应,生成四面体形分子L和直线形分子M。组成E分子中的元素的原子序数都小于10,组成G分子的元素为第三周期的元素。反应过程示意图如下,则下列判断中正确的是( )。
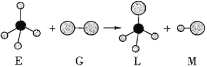
A.常温常压下,E是一种液态有机物B.M是一种含有非极性键的分子
C.干燥的G能漂白湿润的有色物质D.上述反应的类型是加成反应
科目:高中化学 来源: 题型:
【题目】乙醇能发生如下反应:
①![]() ;
;
②![]() ,
,![]() 。
。
由以上反应得出的结论错误的是( )
A.由反应①②可知,条件不同,乙醇与![]() 反应的产物不同
反应的产物不同
B.由反应②可知,![]() 是乙醇氧化生成乙醛的催化剂
是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键、碳氧键 、氢氧键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生称取9 g淀粉溶于水,测定淀粉水解的百分率,其过程如下(已知含有醛基的有机物可在碱性条件下与银氨溶液发生银镜反应生成单质Ag):
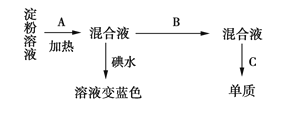
(1)填写各步所加试剂的名称:A.________;B.________;C._________。
(2)只加A而不加B是否可行?____(填“是”或“否”),理由是__________________________________。
(3)当析出2.16 g金属单质时,淀粉的水解率为___(已知1 mol醛基发生银镜反应时生成2 mol Ag)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯的结构简式为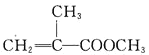 ,是有机玻璃的单体,其一种实验室制备方法如下:实验装置如图1所示(夹持装置及微波加热装置已略去):
,是有机玻璃的单体,其一种实验室制备方法如下:实验装置如图1所示(夹持装置及微波加热装置已略去):
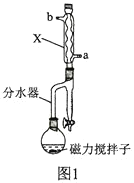
实验步骤如下:
Ⅰ![]() 量取86ml甲基丙烯酸
量取86ml甲基丙烯酸![]()
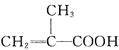
![]() 置于烧杯中,在搅拌的同时加入5ml浓硫酸,冷却至室温,再加入50ml甲醇,搅拌,混合均匀;
置于烧杯中,在搅拌的同时加入5ml浓硫酸,冷却至室温,再加入50ml甲醇,搅拌,混合均匀;
Ⅱ![]() 将混合溶液注入图1装置的反应器中,加入磁力搅拌子,微波加热温度为105℃,持续加热,充分反应;
将混合溶液注入图1装置的反应器中,加入磁力搅拌子,微波加热温度为105℃,持续加热,充分反应;
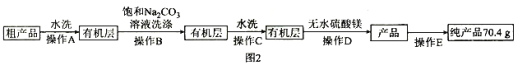
Ⅲ![]() 纯化产品,流程如图2所示:
纯化产品,流程如图2所示:
已知:
|
|
| |
溶解性 | 可溶于有机物、水 | 可溶于热水、酯 | 难溶于水、可溶于有机物 |
密度/gcm-3 | 0.79 | 1.01 | 0.94 |
沸点/℃ | 64.7 | 161 | 100~101 |
相对分子质量 | 32 | 86 | 100 |
回答下列问题:
(1)制备甲基丙烯酸甲酯的化学方程式为______________________________。
(2)图1中仪器X的名称为________________,其进水口应为________________(填“a”或“b”)口。
(3)采用微波加热可准确控制反应温度和时间,若反应温度控制不好,可能有副产物产生,写出一种有机副产物的结构简式:_________。
(4)从分水器中及时分离出水的目的是_____________________,如果分水器中的水层不再增厚,则表明__________________________。
(5)纯化过程中,用“饱和碳酸钠溶液洗涤”的目的是_______________________________;完成操作C应选____________(填选项字母,下同)装置,完成操作D应选____________装置。
(6)本实验中甲基丙烯酸甲酯的产率为_________________![]() 保留三位有效数字
保留三位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸二甲酯可用作制备维生素B13的中间体,也可用作增塑剂。实验室以草酸![]() 和甲醇为原料制备草酸二甲酯的一种方法如下:
和甲醇为原料制备草酸二甲酯的一种方法如下:![]()
![]()
![]() 。
。
相关物质的有关数据如下表所示:
物质 | 苯 | 甲醇 | 草酸二甲酯 |
熔点/℃ | 5.5 | -97 | 54 |
沸点/℃ | 80.1 | 64.3 | 163.5 |
相对分子质量 | 78 | 32 | 118 |
水溶性 | 不溶 | 互溶 | 不溶 |
实验过程:向如图反应装置中加入27g草酸、40g无水甲醇、100ml苯、5ml浓硫酸,搅拌下加热回流;待反应完全后,分离出甲醇和苯,所得反应液经水洗,有机层再用10%的碳酸钠溶液洗涤,然后用蒸馏水洗涤,加无水氯化钙固体干燥;过滤,滤液冷却后析出晶体,干燥,得草酸二甲酯30.1g。
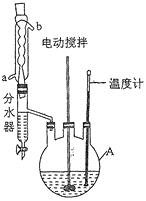
回答下列问题:
(1)仪器A的名称为____________,反应过程中冷却水应从________(填“a”或“b”)口进入。
(2)分离出甲醇和苯的操作名称为______________________________。
(3)用10%的碳酸钠溶液洗涤的目的是____________________________________。
(4)甲醇过量的目的是________________________________________________,浓硫酸的作用是_____________________________________________。
(5)分水器的优点是__________________________________________(任写一点)。
(6)本实验的产率是___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
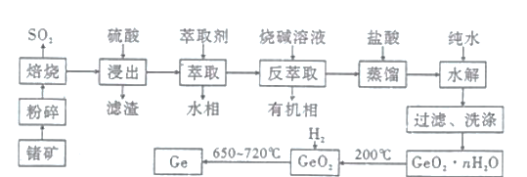
【题目】锗是一种重要的战略资源,在半导体、航空航天测控等领域都有着广泛的应用。下图是以一种锗矿![]() 主要成分为
主要成分为![]() 、
、![]() 、
、![]() 为原料制备锗的工艺流程:
为原料制备锗的工艺流程:
已知:
![]() 为两性氧化物。
为两性氧化物。
![]() “萃取”时用的萃取剂在本实验条件下对
“萃取”时用的萃取剂在本实验条件下对![]() 有很好的选择性。
有很好的选择性。
![]() 的熔、沸点分别为
的熔、沸点分别为![]() 、
、![]() ,极易水解放热。
,极易水解放热。
![]() “蒸馏”过程中发生的反应为
“蒸馏”过程中发生的反应为![]() 。
。
(1)锗在元素周期表中的位置为第_________周期第________族。
(2)“粉碎”的目的是_______________________。
(3)“焙烧”过程中![]() 发生反应的化学方程式为________________。
发生反应的化学方程式为________________。
(4)“滤渣”的成分为________________![]() 填化学式
填化学式![]() ,“水相”中的阳离子除了
,“水相”中的阳离子除了![]() 和
和![]() 外,还有__________________
外,还有__________________![]() 填离子符号
填离子符号![]() 。
。
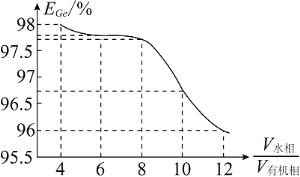
(5)“萃取”时,![]() 锗的萃取率
锗的萃取率![]() 与
与![]() 水相与有机相的体积比
水相与有机相的体积比![]() 的关系如图所示,从生产成本的角度考虑,最适宜的
的关系如图所示,从生产成本的角度考虑,最适宜的![]() 为______________
为______________![]() 填序号
填序号![]() 。
。
![]()
![]()
![]()
![]()
(6)“水解”时反应的化学方程式为_________________,该步实验操作必须在冰盐浴中进行的原因除了有利于水解反应正向进行外,还有______________。
(7)假设流程中每步都没有锗元素损失,若![]() 锗
锗 ![]() 含锗
含锗![]() 经提纯得到
经提纯得到![]() 的锗,则杂质元素的脱除率为_____________
的锗,则杂质元素的脱除率为_____________![]() 用含a、b、c的式子表示
用含a、b、c的式子表示![]() 。
。![]() 已知:杂质元素的脱除率
已知:杂质元素的脱除率![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知:四种原了最外层电子数之和为24。下列说法止确的是
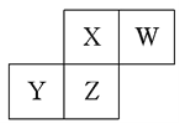
A. 元索Ⅹ和元Z的最高正化合价相同
B. 单核阴离子半径的大小顺序为:r(W)>r(X)
C. 气态简单氢化物的热稳定性顺序为:Y<Z<X<W
D. 元素Z的氧化物对应水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组的同学用50mL ![]() 溶液与
溶液与![]() KOH溶液按图示装置进行中和反应,并根据反应放出的热量计算反应热。下列说法中错误的是
KOH溶液按图示装置进行中和反应,并根据反应放出的热量计算反应热。下列说法中错误的是
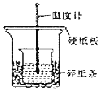
A.两烧杯口应在同一高度,烧杯间应填满碎纸条以减少热量损失
B.为使酸和碱充分混合,图中实验装置应加上环形玻璃搅拌棒和碎纸条
C.实验时![]() 溶液与KOH溶液需一次性混合,还需测量混合液温度的最高值
溶液与KOH溶液需一次性混合,还需测量混合液温度的最高值
D.若换成![]() 溶液与该KOH溶液反应,放出的热量相等
溶液与该KOH溶液反应,放出的热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酰氯(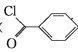 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
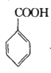 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 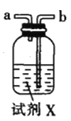 乙.
乙. 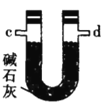 丙.
丙. 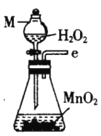 丁.
丁.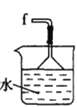 戊.
戊. 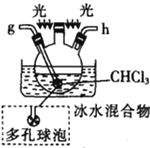
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
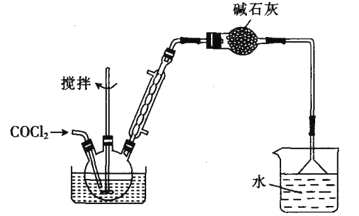
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com