
【题目】下列各组比较正确的是( )
①酸性:![]()
②沸点:![]()
③金属性:![]()
④稳定性:![]()
⑤半径:![]()
A.①②B.②③
C.①③④D.①②③④⑤
【答案】C
【解析】
①元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性P>C>Si,则最高价氧化物对应水化物的酸性:H3PO4>H2CO3>H2SiO3,故正确;
②含有氢键的沸点较高,结构相似的氢化物的相对分子质量越大,沸点越高,HF分子间能形成氢键,其沸点较高,则氢化物沸点:HF>HI>HBr>HCl,故错误;
③同主族元素,从上到下金属性逐渐增强,同周期元素,从左到右金属性逐渐减弱,则金属性K>Na>Mg>Al,故正确;
④元素的非金属性越强,氢化物的稳定性越强,非金属性F>Cl>S,则氢化物的稳定性HF>HCl>H2S,故正确;
⑤金属元素的原子的半径大于离子半径,则半径Na>Na+,故错误;
①③④正确,故选C。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】硫酸在生活和生产中应用广泛。
Ⅰ 某工厂以黄铁矿(主要成分为FeS2)为原料,采用“接触法”制备硫酸。
已知298 K和101 kPa条件下:
2FeS2(s)=2FeS(s)+S(s) ΔH1
S(s)+2O2(g)=2SO2(g) ΔH2
4FeS(s)+7O2(g)=2Fe2O3(s)+4SO2(g) ΔH3
则在该条件下FeS2与O2生成Fe2O3和SO2的总热化学方程式是________。
Ⅱ 催化氧化反应:2SO2(g)+O2(g)2SO3(g) ΔH<0
(1) 在体积可变的密闭容器,维持压强为1×105 Pa和初始n(SO2)=2 mol,充入一定量的O2,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
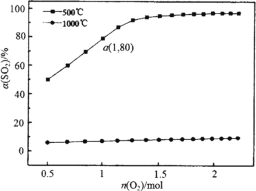
①在1000℃时,SO2平衡转化率随着O2物质的量的增大缓慢升高,解释其原因________。
②a点时SO3的平衡分压p(SO3)=________Pa(保留2位有效数字,某组分的平衡分压=总压×某组分的物质的量分数)。
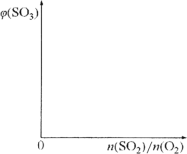
(2)保持温度不变,向固定体积的密闭容器中充入一定量的SO2、O2。请画出平衡体系中SO3的体积分数φ(SO3)随初始SO2、O2的物质的量之比[n(SO2)/n(O2)]的变化趋势图。
(3)已知活化氧可以把SO2快速氧化为SO3。根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化如图所示。下列说法正确的是________。
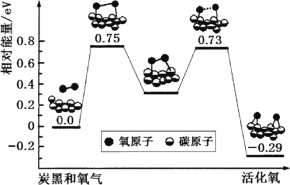
A O2转化为活化氧是氧氧键的断裂与碳氧键的生成过程
B 该过程中最大能垒(活化能)E正=0.73 eV
C 每活化一个O2吸收0.29 eV的能量
D 炭黑可作为SO2转化为SO3的催化剂
E 其它条件相同时,炭黑颗粒越小,反应速率越快
Ⅲ 硫酸工厂尾气中的SO2可被NaOH溶液吸收,用惰性电极将所得的Na2SO3溶液进行电解,可循环再生NaOH的同时得到H2SO4,写出阳极的电极方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如图所示。
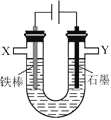
实验一:电解饱和食盐水。
(1)配制饱和食盐水所需的玻璃仪器有:烧杯、量筒、_________________。
(2)电解饱和食盐水的化学方程式为________________。
实验二:电解不饱和食盐水及产物分析。
相同条件下,电解1mol·L-1 NaCl溶液并收集两极产生的气体。在X处收集到V1mL气体,同时,在Y处收集到V2mL气体,停止电解。结果发现V2<V1,且与电解饱和食盐水相比,Y处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
ⅰ.有部分Cl2溶于NaCl溶液中;ⅱ.有O2生成。
(3)设计实验证明有部分Cl2溶于NaCl溶液中。实验方案为:取少量__________电极附近溶液。
(4)证明有O2生成并测定O2的体积。按如右图所示装置进行实验,通过注射器缓缓地将在Y处收集到V2mL气体全部推入装置A(盛有足量试剂NaOH溶液)中,最终,量气管中收集到V3mL气体(设V1、V2、V3均在相同条件下测得)。
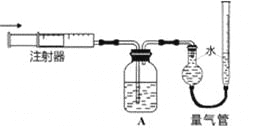
①装置A的作用是_______________。
②本实验中,观察到________________的现象,说明石墨电极上有O2生成。
③实验中是否需要预先除尽装置中的空气?____________(填“是”或“否”)。
(5)实验二中,在石墨电极上产生的Cl2的总体积为________mL(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W、G在元素周期表中的相对位置如下表所示,其中Q是无机非金属材料的主角。下列判断正确的是( )
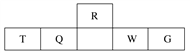
A. 离子半径:T<W<G
B. 等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多
C. 最简单气态氢化物的热稳定性:Q<R
D. T和G组成的化合物溶于水,其水溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法中正确的是( )
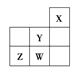
A. Y的原子半径在同周期主族元素中最大
B. W的非金属性比Z的弱
C. Z的气态氢化物的稳定性在同主族元素中最强
D. W的最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
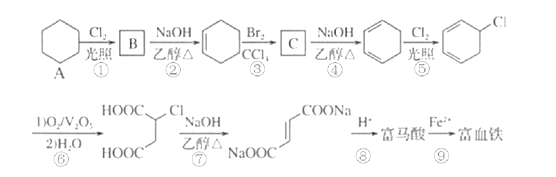
(1)A的化学名称为___;由A生成B的反应类型为__。
(2)C的结构简式为___。
(3)写出③和④的化学反应方程式:
反应③:___。
反应④:___。
(4)富马酸不能发生的反应___。
A.取代反应 B.加成反应 C.消去反应 D.氧化反应
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出___LCO2(标况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8 = Li2S8)工作原理示意图如图。

下列有关该电池说法不正确的是( )
A.A 电极为该电源的负极,电极材料主要是金属锂和石墨烯
B.B 电极的反应:2Li++S8+2e = Li2S8
C.充电时,电极A与电源负极连接,作为阴极
D.为提高电池效率,该电池可选用稀硫酸作为电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关![]() 反应的叙述正确的为
反应的叙述正确的为
A.还原剂与氧化剂物质的量之比为5:3
B.生成lmolO2,反应共转移4mol电子
C.若有5mol水做还原剂时,被BrF3还原的BrF3为![]() mol
mol
D.若有5mol水参与反应时,被水还原的BrF3为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
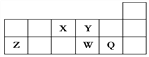
A. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B. 元素W的最高价氧化物对应的水化物酸性比Q的强
C. 元素X与元素Z的最高正化合价之和的数值等于8
D. 离子Y2-和Z3+的核外电子数和电子层数都不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com