
【题目】某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如图所示。
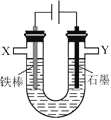
实验一:电解饱和食盐水。
(1)配制饱和食盐水所需的玻璃仪器有:烧杯、量筒、_________________。
(2)电解饱和食盐水的化学方程式为________________。
实验二:电解不饱和食盐水及产物分析。
相同条件下,电解1mol·L-1 NaCl溶液并收集两极产生的气体。在X处收集到V1mL气体,同时,在Y处收集到V2mL气体,停止电解。结果发现V2<V1,且与电解饱和食盐水相比,Y处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
ⅰ.有部分Cl2溶于NaCl溶液中;ⅱ.有O2生成。
(3)设计实验证明有部分Cl2溶于NaCl溶液中。实验方案为:取少量__________电极附近溶液。
(4)证明有O2生成并测定O2的体积。按如右图所示装置进行实验,通过注射器缓缓地将在Y处收集到V2mL气体全部推入装置A(盛有足量试剂NaOH溶液)中,最终,量气管中收集到V3mL气体(设V1、V2、V3均在相同条件下测得)。
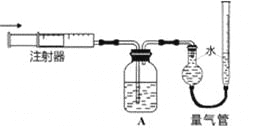
①装置A的作用是_______________。
②本实验中,观察到________________的现象,说明石墨电极上有O2生成。
③实验中是否需要预先除尽装置中的空气?____________(填“是”或“否”)。
(5)实验二中,在石墨电极上产生的Cl2的总体积为________mL(用代数式表示)。
【答案】玻璃棒 2NaCl+2H2O![]() Cl2↑+ H2↑+ 2NaOH 取少量石墨电极附近溶液,滴在淀粉KI试纸上,试纸变蓝 除去Cl2 量气管右侧液面上升(或其他合理答案) 否 v1-2 v3
Cl2↑+ H2↑+ 2NaOH 取少量石墨电极附近溶液,滴在淀粉KI试纸上,试纸变蓝 除去Cl2 量气管右侧液面上升(或其他合理答案) 否 v1-2 v3
【解析】
实验一:电解饱和食盐水.
(1)一定水中不能再溶解食盐固体时所得的溶液即为饱和食盐水,所以配制饱和食盐水的操作为在烧杯中加入一定量的蒸馏水,边搅拌边加入食盐固体,直到固体不再继续溶解为止,所需的玻璃仪器有:烧杯、量筒、玻璃棒,故答案为玻璃棒;
(2)电解饱和食盐水阳极为氯离子失电子生成氯气,阴极为氢离子得电子生成氢气,化学方程式为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,故答案为2NaCl+2H2O
Cl2↑+H2↑+2NaOH,故答案为2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;
实验二:电解不饱和食盐水及产物分析,
(3)因为氯气可使湿润的淀粉KI试纸变蓝,所以证明有部分C12溶解于NaCl溶液中,可取少量石墨电极附近溶液,滴在淀粉KI试纸上,试纸变蓝,说明含有氯气,故答案为石墨;滴在淀粉KI试纸上,试纸变蓝;
(4)①因为Y为阳极处收集到的V2mL气体中主要是氯气,所以证明有O2生成首先要除去氯气,则装置A的作用是完全吸收氯气,除去Cl2,故答案为除去Cl2;
②当量气管的右侧液面上升,则说明含有氧气生成,故答案为量气管的右侧液面上升;
③本身的空气对压强不影响,所以实验中不需要预先除净装置中的空气,故答案为否;
(5)因为阴极X处收集到的氢气为V1mL气体,阳极Y处收集到为氯气和氧气,根据(4)最终量气管中收集到V3mL气体即氧气,设在石墨电极上生成Cl2的总体积为xml,则根据电解阴阳两极的得失电子守恒,V1×2=x×2+V3×4,所以x=V1-2V3,故答案为v1-2v3。


科目:高中化学 来源: 题型:
【题目】Ⅰ.下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL 0.1mol/L NaCl溶液
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:则C (NaOH) = ______________。

(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏______。
III. 我们知道空气中含有N2、O2、CO2、H2S等气体。试判断下列滴定操作的终点、分析下列现象的原因,并写出有关离子方程式。
(1)以酚酞为指示剂,用碱液滴定酸液到___________________________为终点。约半分钟后导致褪色的原因:________________________________________________。
(2)以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2=S4O62-+2I-)到 __________________为终点,约5min后溶液又显色的原因: _________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是

A. BaTi8O12
B. BaTiO3
C. BaTi2O4
D. BaTi4O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用.其工作流程如图1所示:
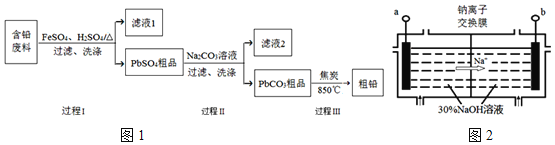
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是______.
(2)过程Ⅰ中,Fe2+催化过程可表示为:
![]()
![]() .
.
![]() 写出ii的离子方程式:______.
写出ii的离子方程式:______.
![]() 下列实验方案可证实上述催化过程.将实验方案补充完整.
下列实验方案可证实上述催化过程.将实验方案补充完整.
![]() 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
![]() ______.
______.
(3)过程Ⅱ的目的是脱硫.若滤液2中c(SO42-)=1.6molL-1,c(CO32-)=0.1molL-1,则PbCO3中______![]() 填“是”或“否”
填“是”或“否”![]() 混有PbSO4.
混有PbSO4.
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示.将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:![]()
![]() 与外接电源的______极相连.
与外接电源的______极相连.
![]() 电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
![]() 与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列表格,回答有关问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
一 | ||||||||
二 | a | b | c | d | ||||
三 | e | f | g | h | i | j | k | l |
(1)上表中,a元素的元素符号为____,第一电离能最小的元素是____(填元素名称,下同),电负性最大的元素是___。
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是____(填化学式,下同),碱性最强的是_____。
(3)某元素最高价氧化物对应的水化物呈两性,则该元素是/span>_____(填对应的字母),该元素与c元素形成的化合物能否与NaOH溶液反应(若能,写出相应的离子方程式;若不能,则填“否”)_______。
(4)在e~k元素的原子中,原子半径最小的是_____(填元素符号),其价电子排布式为_________;未成对电子数最多的是____(填元素符号),其最高价氧化物对应水化物的化学式为_____;有两个未成对电子的元素是____(填元素符号);M层有两个空轨道的是____(填元素符号),其阳离子结构示意图为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种有机化合物的结构简式如下所示,均含有多个官能团,下列有关说法中正确的是( )
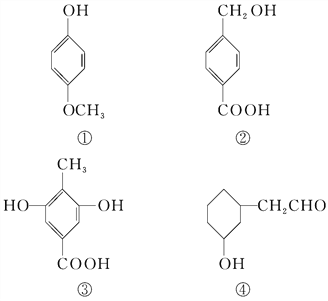
A.①属于酚类,可与NaHCO3溶液反应产生CO2
B.②属于酚类,能使FeCl3溶液显紫色
C.1 mol ③最多能与3 mol Br2发生反应
D.④属于醇类,可以发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如下 ,下列有关说法不正确的是
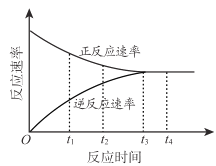
A.t1 时刻,反应向逆反应方向进行
B.t2 时刻,正反应速率大于逆反应速率
C.t3 时刻,反应刚好达到平衡状态
D.t4时刻,反应限度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,连二亚硫酸钠又称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如图:
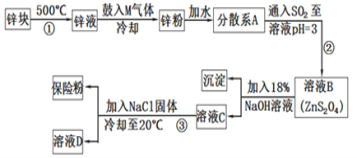
请回答下列问题:
(1)保存连二亚硫酸钠的注意事项___(任写一项)。
(2)鼓入的气体M为空气的一种主要成分,则M的电子式为___;
(3)流程②的化学方程式为__。
(4)流程③的分离方法步骤为过滤、洗涤、干燥。其中洗涤所用试剂是___;实验时加入NaCl固体的作用是__。
(5)连二亚硫酸钠可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),写出该反应的离子方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com